Maksan ja munuaisten glukoosin esiasteena l-laktaatti tunnustetaan nyt myös energiasubstraatiksi useimmissa soluissa sen hapettumisen kautta pyruvaatiksi. Tämän hapettumisen, jonka oletetaan tapahtuvan sytosolissa, katalysoi l-laktaattidehydrogenaasi, jonka jälkeen pyruviitti katabolisoituu mitokondrioissa. Hiljattain on kuitenkin tunnustettu, että mitokondrioilla on merkitystä l-laktaattiaineenvaihdunnassa: Dianzani (1) ehdotti mitokondriaalisen l-laktaattidehydrogenaasin (m-l-LDH) olemassaoloa, ja myöhemmin Baba ja Sharma (2) osoittivat sen sijaitsevan mitokondriomatriisissa (3). L-laktaatin kuljetus ja aineenvaihdunta onkin osoitettu erilaisissa mitokondrioissa, kuten luurankolihaksessa (4), rotan sydämessä (5), maksassa (6), aivoissa (7-9), pikkuaivojen granulussoluissa (10), kanin gastrocnemiuksessa (11), siittiösoluissa (12), sian maksassa (13) ja jopa kasvissa (14). Näin m-l-LDH:n olemassaolo tunnustettiin Passarellan ym. (3), Brooksin (15) ja Schurrin (16) tarkastelun perusteella sisällyttämällä se MitoCartaan (http://www.broadinstitute.org/pubs/MitoCarta/index.htrnl). Odotetusti, kun otetaan huomioon l-LDH:n läsnäolo matriisissa, l-laktaatin kantajien esiintyminen on osoitettu toiminnallisissa tutkimuksissa puhdistetuilla, kytketyillä mitokondrioilla. Näitä ovat l-laktaatti/H+ -symporteri sekä l-laktaatti/pyruvaatti- ja l-laktaatti/oksaloasetaatti-antiporterit (3). Yllättävää kyllä, ylivoimaiset todisteet mitokondrioiden sisällä sijaitsevasta m-l-LDH:sta eivät ole yleisesti hyväksyttyjä, sillä jotkut tutkijat suhtautuvat edelleen epäilevästi m-l-LDH:n olemassaoloon, kun taas toiset paikallistavat m-l-LDH:n kalvojen väliseen tilaan (17). Mielestämme skeptisyys saattaa johtua vaikeuksista, jotka liittyvät kytkettyjen mitokondrioiden eristämiseen, mikä ei ole helppo tehtävä erityisesti luurankolihasnäytteiden kohdalla, tai siitä, ettei reaktiomedian valinnassa ja inhibiittoreiden käyttämisessä oikeissa pitoisuuksissa ole oltu tarpeeksi huolellisia (11). Se, että m-l-LDH on lokalisoitunut mitokondrioiden sisälle, osoitetaan jäljempänä.
Kuljetetaanko ja metaboloidaanko l-laktaattia syöpäsolujen mitokondrioissa?
Kyllä, kuljetetaan. Vaikka Warburg havaitsi 1920-luvulla, että syöpäsolut tuottavat mieluummin ATP:tä glykolyysin avulla l-laktaattia tuottaen, l-laktaatin mitokondriaalista aineenvaihduntaa ei tietojemme mukaan ollut tutkittu syöpäsoluissa ennen vuotta 2010, jolloin julkaistiin ensimmäiset todisteet l-laktaatin mitokondriaalisesta aineenvaihdunnasta näissä soluissa (Gabriella Chieppa raportoi sen jo vuonna 2008 väitöskirjassaan Molisen yliopistossa) (18). Tässä tapauksessa l-laktaatin kuljetuksen ja aineenvaihdunnan tutkimiseksi sekä normaaleista että syöpäsoluista eristetyissä mitokondrioissa käytettiin spektroskooppisia ja polarografisia tekniikoita, joissa seurattiin joko m-l-LDH-reaktiota tai mitokondrioiden hapenkulutusta, kun niihin lisättiin l-laktaattia ulkopuolelta (19), sen sijaan, että käytettäisiin monimutkaisempia menetelmiä, joita on saatavilla molekyylibiologian, genetiikan ja kemian laboratorioissa. Kaksi ensin mainittua tekniikkaa valittiin, koska ne mahdollistavat tutkittujen prosessien kinetiikan jatkuvan seurannan useita minuutteja kestävissä kokeissa, joissa mitokondriot pysyvät kytkettyinä. Sitä vastoin jälkimmäisillä menetelmillä tehtävät mittaukset tehdään yleensä sen jälkeen, kun prosessit ovat jo päättyneet. Näin ollen intramitokondriaalisten pyridiininukleotidien redox-tilan nousu, kuten fluorimetriset mittaukset osoittavat, kun l-laktaattia lisätään mitokondrioihin, viittaa siihen, että l-laktaattiaineenvaihdunta tapahtuu organellien sisällä NAD+-riippuvaisen m-l-LDH:n välityksellä; valitettavasti mitokondriaalisen l-laktaattiaineenvaihdunnan esiintymistä syöpäsoluissa ei noteerattu Ferguson et al. (17) mahdollisesti siksi, että katsauksen kirjoittajat pitävät spektroskooppisia ja polarografisia tekniikoita ”ongelmallisina”, vaikka lukuisat tutkijat käyttävät niitä laajalti. Sitä, että heidän mielipiteensä on vähemmistön mielipide, voidaan havainnollistaa lainaamalla Mayevskyn ja Rogatskyn (20) katsausta, jossa todetaan, että ”eri ryhmien julkaisujen suuri määrä todistaa arvokasta tietoa, jota on kerätty erilaisissa koeolosuhteissa. Kudoksen NADH-tasojen seuranta antaa tärkeintä tietoa mitokondrioiden aineenvaihdunnallisesta tilasta.” m-l-LDH:n olemassaolo voidaan vahvistaa myös immunologisesti mitokondrioissa, joissa ei todistetusti ole sytosolista kontaminaatiota.
Huomaa, että siinä tapauksessa, että m-l-LDH:n ehdotetaan paikallistuvan kalvojen väliseen tilaan, intramitokondriaalisen pyridiininukleotidin fluoresenssin lisääntyminen selittyy seuraavasti: l-laktaatti kulkeutuu mitokondrioiden kalvojen väliseen tilaan, jossa se hapettuu pyruvaatiksi, joka puolestaan ylittää mitokondrioiden sisemmän kalvon hapettuakseen mitokondrioiden sisäpuolella pyruvaattidehydrogenaasikompleksin kautta . Useat kokeelliset havainnot eivät tue tällaista mekanismia. Esimerkiksi de Bari et al. (18) osoittivat, että NAD+:n pelkistyminen jatkuu huolimatta pyruvaattidehydrogenaasin inhibiittorina toimivan arseniitin läsnäolosta, mutta oksamaatti, l-LDH:n inhibiittori, estää sen. Lisänäyttöä m-l-LDH:n läsnäoloa vastaan kalvojen välitilassa saadaan kokeellisista tuloksista, jotka osoittavat, että l-laktaatti pääsee mitokondrioihin olosuhteissa, joissa pyruviitti ei ole läpäisevä yhdiste (21) tai joissa pyruviitti/H+ -symporteri on estetty inhibiittorilla (6). Näitä kokeellisia lähestymistapoja voidaan tulevaisuudessa soveltaa myös hapenkulutuksen (ADP:n läsnäollessa tai puuttuessa), protonien ulosvirtauksen ja kalvopotentiaalin muodostumisen mittaamiseen. Soveltamalla kontrollin voimakkuuskriteeriä erilaisilla ei-läpäisevillä inhibiittoreilla (19) voidaan selvittää, heijastaako edellä mainittujen prosessien nopeus l-laktaatin kuljetusta mitokondriokalvon läpi. Näin l-laktaatin kuljetusta voidaan tutkia kvantitatiivisesti, mukaan lukien hyperbolisen kinetiikan esiintyminen, pH-profiili jne. Lisäksi pyruvaatti- ja l-laktaatti-riippuvaisten mitokondrioprosessien inhibitioprofiilien vertailu sellaisten yhdisteiden avulla, jotka eivät pääse mitokondrioihin, mahdollistaa l-laktaatin ja pyruvaatin kuljettajien erottamisen toisistaan.
Lyhyesti sanottuna on myös osoitettu, että ulkoisesti lisätty l-laktaatti pääsee sekä normaaleihin että syöpäsoluihin sekä normaaleihin että syöpäsairaisiin eturauhassyövän soluihin, ja se pääsee erityisesti kuljettimella kulkeutumalla mitokondrioihinsa, joissa on olemassa sisäisessä lokerossa sijaitseva l- LDH. On osoitettu, että m-l-LDH:t eroavat sytosolisista entsyymeistä, jotka puolestaan eroavat toisistaan. Normaaleissa ja syöpäsoluissa on eroja m-l-LDH:n proteiinipitoisuuden ja aktiivisuuden suhteen, jolloin sekä entsyymin ilmentyminen että aktiivisuus ovat suurempia syöpäsoluissa.
Vuonna 2011 osoitettiin monokarboksylaattikuljettajan (MCT) ja LDH:n proteiinien olemassaolo rintasyöpäsolulinjojen mitokondriaalisissa verkkokalvoissa (22). Tällöin mitattiin sekä MCT:n että l-LDH:n ilmentymistä, ja niiden mitokondriaalinen lokalisaatio määritettiin immunofluoresenssilla, tekniikalla, joka ei mahdollista submitokondriaalisen lokalisaation tunnistamista.
Laaja-alaisempi tutkimus l-laktaatin kuljettamisesta ja aineenvaihdunnasta syöpäsolujen mitokondrioissa tehtiin ihmisen hepatosellulaarisen karsinooman (Hep G2) soluilla (21), joissa tapahtuu glukoneogeneesi (23). Hep G2-solujen mitokondrioissa (Hep G2-M) on m-l-LDH, joka rajoittuu sisäiseen mitokondriokompartimenttiin. Sytosolisten ja mitokondriaalisten l-LDH:iden havaittiin eroavan toisistaan myös kyllästymiskinetiikaltaan. Näissä mitokondrioissa on myös osoitettu kantoaineen välityksellä tapahtuva l-laktaatin kuljetus. Tärkeää on, että ensimmäisen kerran osoitettiin eri aineenvaihduntatuotteiden, kuten pyruvaatin, oksaloasetaatin, malaatin ja sitraatin, poistuminen, joka johtuu l-laktaatin lisäyksestä mitokondrioihin, mikä antoi ensimmäisen näkemyksen l-laktaatin mitokondriaalisen metabolian merkityksestä; vastaavasti osoitettiin myös l-laktaatti/pyruvaatti-sukkulan esiintyminen, joka on omistettu sytosolisen NADH:n hapettamiseen. Viime kädessä hapettumistuotteen poistaminen kuljettajavälitteisen kuljetuksen ja mitokondriaalisen metabolian avulla voittaa kaikki teoreettiset termodynaamiset vaikeudet, joiden katsottiin sulkevan pois l-laktaatin hapettumisen mitokondrioissa.
Nämä havainnot viittaavat vahvasti siihen, että glukoosiaineenvaihdunnan dogmaattista näkemystä on tarkistettava siten, että keskitytään erityisellä tavalla l-laktaatin ja m-l-LDH:n rooliin glukoneogeneesissä. Näin ollen myös Cori-sykli (joka muotoiltiin vuonna 1929 energiaa vaativaksi aineenvaihduntareitiksi eläimissä, jossa glukoosin hiiliatomit kulkevat ympyränmuotoista reittiä pitkin: lihaksen glykogeeni → veren laktaatti → maksa (jossa glukoneogeneesi tapahtuu) → veren glukoosi → lihaksen glukoosi → lihaksen glykogeeni) vaatii tarkistusta. Tältä osin solun l-laktaattihapetus, joka on välttämätön glukoosin tuottamiseksi Cori-syklissä, on perinteisesti postuloitu tapahtuvan sytosolissa, mutta tapahtuuko se? Sytosolinen l-l-LDH (c-l-LDH) on pelkistävä entsyymi, glykolyyttisen reitin viimeinen vaihe, joka muuttaa pyruviitin l-laktaatiksi ja huolehtii siten NAD+:n uudistumisesta. Tämän reaktion pitäisi jatkua keskeytyksettä hapen läsnäolosta tai poissaolosta riippumatta, sillä pyruvaatin muuntamisen l-laktaatiksi vakiovapaan energian (ΔG0′) muutos on noin -6 kcal/mol. Lisäksi pyruvaatin suuri affiniteetti c-l-LDH:hon selittäisi sen, että normaali / suhde veressä ja muissa kudoksissa on >10, arvo, joka ei voi vastata ehdotusta, jonka mukaan pyruvaatti olisi glykolyysin lopputuote normaaliolosuhteissa. Tämän vuoksi dogmaattinen kuvaus tästä reaktiosta kaksisuuntaisena on harhaanjohtava, ja se on tähän asti hyväksytty mahdollisen vaihtoehdon puuttumisen vuoksi. Väitämme, että l-laktaatin hapettuminen takaisin pyruvaatiksi ei tapahdu sytosolissa, vaan se tapahtuu mitokondrioissa. On todellakin vain kaksi vaihtoehtoa estää l-laktaatin kertyminen sytosoliin: joko l-laktaatti kuljetetaan ulos solusta (anaerobisissa olosuhteissa) ja/tai se hapetetaan m-l-LDH:n avulla sen kulkeutuessa mitokondrioon (aerobisissa olosuhteissa). Näin ollen, vaikka olisimme samaa mieltä Lu et al. (24) kanssa siitä, että ”suurin osa glykolyysistä peräisin olevasta pyruvaatista ohjataan laktaattikäymiseen”, emme voi hyväksyä sitä, että l-laktaatti ”pidetään poissa mitokondrioiden oksidatiivisesta aineenvaihdunnasta.”
Erityisen kiinnostavaa on se, että pyruvaatti ei pääse Hep G2-M:ään. Itse asiassa, toisin kuin malaatti + glutamaatti ja l-laktaatti, ulkoisesti lisätty pyruviitti ei aiheuta hapenkulutusta eikä kalvopotentiaalin muodostumista . Huomattakoon, että Paradies ym. ovat raportoineet pyruvaatin kuljetuksen heikkenemisestä syöpäsoluissa (25). Riippumatta siitä, että l-laktaatin hapettuminen sytosolissa on teoreettisesti mahdotonta, kuten edellä selitettiin, klassista Cori-sykliä ei siis voi tapahtua Hep G2-soluissa. Siksi tarjoamme tarkistetun Cori-syklin (kuva 1), jossa on mukana sekä mitokondriokuljettajat, jotka välittävät l-laktaatista riippuvaista liikennettä, että m-l-LDH, joka tuottaa pyruvaattia mitokondrioiden sisällä. Näin ollen l-laktaatin ottamisesta ja aineenvaihdunnasta m-l-L-LDH:n, pyruviittidehydrogenaasin, pyruviittikarboksylaasin ja malaattidehydrogenaasin välityksellä sekä vaihdoista peräisin olevien oksaloasetaatin ja malaatin ilmaantuminen mitokondrioiden ulkopuolelle l-laktaatin ottamisen ja aineenvaihdunnan kautta m-l-LDH:n, pyruviittidehydrogenaasin, pyruviittikarboksylaasin ja malaattidehydrogenaasin välityksellä sekä vaihtojen kautta, jotka johtuvat luultavasti l-laktaatti/oksaloasetaatti- ja l-laktaatti/malaatti-antiportaattoreiden toiminnasta, vahvistaa l-laktaatilla olevan apleroottisen roolin glukoneogeneesin kannalta, ja siinä mitokondrioiden merkitys on ainutlaatuinen. Tärkeää on, että l-laktaatin lisääminen Hep G2-M:ään johtaa rasvahappojen esiasteen, sitraatin, ilmaantumiseen mitokondrioiden ulkopuolelle. Vastaavasti korkearesoluutioisen massaspektrometrian avulla havaittiin l-laktaatin pääsy HeLa- ja H460-solujen mitokondrioihin ja osoitettiin, että se johtaa lipidisynteesiin; lisäksi läpäisyelektronimikroskopia vahvisti, että LDH on lokalisoitunut mitokondrioihin (26). Yllättäen l-laktaatin mitokondriaalisen aineenvaihdunnan anapleroottista roolia ei ole otettu huomioon, kun syövän aineenvaihduntaa ”tutkittiin uudelleen” (27).
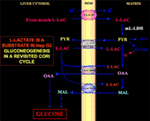
Kuva 1. Kori-sykli uudelleen tarkasteltuna Hep G2-soluissa. Ottaen huomioon, että pyruviitti ei voi päästä Hep G2-M:ään, kuten Pizzuto ym. osoittivat. (21), lihaksissa tuotettu l-laktaatti pääsee verenkierron kautta maksaan ja sytosolista mitokondrioihin; matriisissa l-laktaattiaineenvaihdunta tuottaa m-L-LDH:n kautta pyruviittia (PYR) ja sen jälkeen oksaloasetaattia (OAA) ja malaattia (MAL), jotka viedään mitokondrioista sytosoliin kolmen oletetun kuljettajan välityksellä l-laktaatti-pyruvaattisukkulan ja glukoneogeneesin kuljettamiseksi mekanismilla, joka on samankaltainen kuin se, jonka de Bari et al. ovat jo osoittaneet. (6).
Katsomme, että ehdotettua Cori-syklin tarkistusta, joka on välttämätön Hep G2-soluille, olisi harkittava myös kaikissa muissa solutyypeissä, joissa l-laktaatin mitokondriaalinen metabolia on aktiivista. Esimerkiksi mitokondriaalisesta l-laktaatin otosta/metaboliasta johtuvan in vitro -glukoneogeneesin osittainen rekonstruointi osoitettiin ilman LDH:ta mitokondrioiden ulkopuolella (6).
Mitokondriaalisen l-laktaattiaineenvaihdunnan rooliin on syytä keskittyä tarkemmin: Ottaen huomioon, että vetyperoksidin tuotanto kasvaimen mikroympäristössä ruokkii syöpäsolujen anabolista kasvua (28), olisi tutkittava rotan maksan mitokondrioissa vetyperoksidia tuottavan rotan maksan mitokondrioissa (29) olevan oletetun mitokondriaalisen l-laktaattioksidaasin (LOX) mahdollista roolia; LOX:n olemassaolo Hep G2-M:ssä näyttäisi olevan johdonmukainen sen todisteen kanssa, että rotenoni, joka estää malaatin + glutamaatin lisäyksen indusoiman hapen kulutuksen, ei onnistu estämään hapen kulutusta, joka on saatu aikaan lisäämällä l-laktaatti.
Author Contributions
SP ideoi tämän lausunnon, jakoi sen ja kirjoitti sen yhdessä AS:n kanssa.
Conflict of Interest Statement
Tekijät ilmoittavat, että tutkimus suoritettiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
Tarkastaja ilmoitti käsittelytoimittajalle, että hänellä on yhteinen sidonnaisuus ilman yhteistyötä yhden kirjoittajan kanssa.
1. Dianzani MU. Maitohappooksidaasin jakautuminen normaalien rottien ja rottien, joilla on maksan rasvarappeuma, maksa- ja munuaissoluissa. Arch Fisiol (1951) 50:181-6.
Google Scholar
2. Baba N, Sharma HM. Histochemistry of lactic dehydrogenase in heart and pectoralis muscles of rat J Cell Biol (1971) 51:621-35.
Google Scholar
3. Passarella S, de Bari L, Valenti D, Pizzuto R, Paventi G, Atlante A. Mitochondria and L-lactate metabolism. FEBS Lett (2008) 582:3569-76. doi:10.1016/j.febslet.2008.09.042
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Dubouchaud H, Butterfield GE, Wolfel EE, Bergman BC, Brooks GA. LDH:n, MCT1:n ja MCT4:n kestävyysharjoittelu, ilmentyminen ja fysiologia ihmisen luustolihaksissa. Am J Physiol Endocrinol Metab (2000) 278:E571-9. doi:10.1152/ajpendo.2000.278.4.E571
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Valenti D, de Bari L, Atlante A, Passarella S. L-laktaatin kuljetus rotan sydämen mitokondrioihin ja L-laktaatti/pyruvaattisukkulan rekonstruktio. Biochem J (2002) 15:101-4. doi:10.1042/bj3640101
PubMed Abstract | CrossRef Full Text | Google Scholar
6. de Bari L, Atlante A, Valenti D, Passarella S. In vitro -glukoneogeneesin osittainen rekonstruktio, joka johtuu mitokondriaalisesta L-laktaatin otosta/metaboliasta ja oksaloasetaatin viennistä uusien L-laktaattitranslokaattorien kautta. Biochem J (2004) 380:231-42. doi:10.1042/bj20031981
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Schurr A. Lactate: the ultimate cerebral oxidative energy substrate? J Cereb Blood Flow Metab (2006) 26:142-52. doi:10.1038/sj.jcbfm.9600174
CrossRef Full Text | Google Scholar
8. Schurr A, Payne RS. Laktaatti, ei pyruvaatti, on hermoston aerobisen glykolyysin lopputuote: in vitro -elektrofysiologinen tutkimus. Neuroscience (2007) 147:613-9. doi:10.1016/j.neuroscience.2007.05.002
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Hashimoto T, Hussien R, Cho H-S, Kaufer D, Brooks GA. Todisteet mitokondriaalisesta laktaattihapetuskompleksista rotan neuroneissa: ratkaiseva komponentti aivojen laktaattisukkulalle. PLoS One (2008) 3:e2915. doi:10.1371/journal.pone.0002915
CrossRef Full Text | Google Scholar
10. Atlante A, de Bari L, Bobba A, Marra E, Passarella S. L-laktaatin kuljetus ja aineenvaihdunta tapahtuvat pikkuaivojen granulussolujen mitokondrioissa ja muuttuvat soluissa, joissa tapahtuu alhaisesta kaliumista riippuvainen apoptoosi. Biochim Biophys Acta (2007) 1767:1285-99. doi:10.1016/i.bbabio.2007.08.003
CrossRef Full Text | Google Scholar
11. Passarella S, Paventi G, Pizzuto R. Mitokondriaalisen L-laktaattidehydrogenaasin asia. Front Neurosci (2014) 8:407. doi:10.3389/fnins.2014.00407
CrossRef Full Text | Google Scholar
12. Paventi G, Lessard C, Bailey JL, Passarella S. Villisian siittiöiden kapasitaatiossa L-laktaatti ja sukkinaatti, mutta ei pyruviitti ja sitraatti, vaikuttavat mitokondrioiden kalvopotentiaalin nousuun, jota seurataan safraniini O -fluoresenssin avulla. Biochem Biophys Res Commun (2015) 462:257-62. doi:10.1016/j.bbrc.2015.04.128
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Paventi G, Pizzuto R, Passarella S. L-laktaattidehydrogenaasin esiintyminen sian maksan sisäisessä mitokondriokompartimentissa. Biochem Biophys Res Commun (2017) 489:255-61. doi:10.1016/j.bbrc.2017.05.154
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Paventi G, Pizzuto R, Chieppa G, Passarella S. L-laktaattiaineenvaihdunta perunamukulan mitokondrioissa. FEBS J (2007) 274:1459-69. doi:10.1111/j.1742-4658.2007.05687.x
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Brooks GA. Solu-solu- ja solunsisäiset laktaattisukkulat. J Physiol (2009) 587:5591-600. doi:10.1113/jphysiol.2009.178350
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Schurr A. Aivojen glykolyysi: vuosisadan jatkuva väärinkäsitys ja väärinkäsitys. Front Neurosci (2014) 8:360. doi:10.3389/fnins.2014.00360
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Ferguson BS, Rogatzki MJ, Goodwin ML, Kane DA, Rightmire Z, Gladden LB. Laktaattiaineenvaihdunta: historiallinen konteksti, aiemmat väärät tulkinnat ja nykyinen ymmärrys. Eur J Appl Physiol (2018) 118:691-728. doi:10.1007/s00421-017-3795-6
PubMed Abstract | CrossRef Full Text | Google Scholar
18. de Bari L, Chieppa G, Marra E, Passarella S. L-laktaattiaineenvaihdunta voi tapahtua normaaleissa ja syövän aiheuttamissa eturauhassoluissa uudenlaisen mitokondriaalisen L-laktaattidehydrogenaasien kautta. Int J Oncol (2010) 37:1607-20. doi:10.3892/ijo-00000815
CrossRef Full Text | Google Scholar
19. Passarella S, Atlante A, Valenti D, de Bari L. Mitokondriokuljetuksen rooli energia-aineenvaihdunnassa. Mitochondrion (2003) 2:319-43. doi:10.1016/S1567-7249(03)00008-4
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Mayevsky A, Rogatsky GG. Mitokondrioiden toiminta in vivo arvioituna NADH-fluoresenssilla: eläinmalleista ihmistutkimuksiin. Am J Physiol Cell Physiol (2007) 292:C615-40. doi:10.1152/ajpcell.00249.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Pizzuto R, Paventi G, Porcile C, Sarnataro D, Daniele A, Passarella S. L-laktaattiaineenvaihdunta HEP G2-solun mitokondrioissa L-laktaattidehydrogenaasin ansiosta määrittää laktaatti/pyruvaattisukkulan esiintymisen ja oksaloasetaatin, malaatin ja sitraatin esiintymisen mitokondrioiden ulkopuolella. Biochim Biophys Acta (2012) 1817:1679-90. doi:10.1016/j.bbabio.2012.05.010
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Hussien R, Brooks GA. Mitokondriaalisen ja plasmakalvon laktaattikuljettajan ja laktaattidehydrogenaasin isoformien ilmentyminen rintasyöpäsolulinjoissa. Physiol Genomics (2011) 43:255-64. doi:10.1152/physiolgenomics.00177.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Okamoto T, Kanemoto N, Ban T, Sudo T, Nagano K, Niki I. Uuden menetelmän luominen ja karakterisointi glukoneogeneesin arvioimiseksi käyttäen maksan solulinjoja, H4IIE ja HepG2. Arch Biochem Biophys (2009) 491:46-52. doi:10.1016/j.abb.2009.09.015
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Lu J, Tan M, Cai Q. Warburgin vaikutus kasvaimen etenemisessä: mitokondrioiden oksidatiivinen aineenvaihdunta etäpesäkkeen vastaisena mekanismina. Cancer Lett (2015) 356:156-64. doi:10.1016/j.canlet.2014.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Paradies G, Capuano F, Palombini G, Galeotti T, Papa S. Pyruvaatin kuljetus eri kasvainsolujen mitokondrioissa. Cancer Res (1983) 43:5068-71.
PubMed Abstract | Google Scholar
26. Chen YJ, Mahieu NG, Huang X, Singh M, Crawford PA, Johnson SL, et al. Laktaattiaineenvaihdunta liittyy nisäkkäiden mitokondrioihin. Nat Chem Biol (2016) 12:937-43. doi:10.1038/nchembio.2172
PubMed Abstract | CrossRef Full Text | Google Scholar
27. San-Millán I, Brooks GA. Syövän aineenvaihdunnan uudelleen tutkiminen: laktaatin tuotanto karsinogeneesiä varten voisi olla Warburgin vaikutuksen tarkoitus ja selitys. Carcinogenesis (2017) 38:119-33. doi:10.1093/carcin/bgw127
CrossRef Full Text | Google Scholar
28. Martinez-Outschoorn UE, Lin Z, Trimmer C, Flomenberg N, Wang C, Pavlides S, et al. Cancer cells metabolically ”fertilize” the tumor microenvironment with hydrogen peroxide, driving the Warburg effect: implications for PET imaging of human tumors. Cell Cycle (2011) 10:2504-20. doi:10.4161/cc.10.15.16585
CrossRef Full Text | Google Scholar
29. de Bari L, Valenti D, Atlante A, Passarella S. L-laktaatti synnyttää vetyperoksidia puhdistetuissa rotan maksan mitokondrioissa membraanien väliseen tilaan paikallistetun putatiivisen L-laktaatti-oksidaasioksidaasin ansiosta. FEBS Lett (2010) 584:2285-90. doi:10.1016/j.febslet.2010.03.038
CrossRef Full Text | Google Scholar