タンパク質の構造と機能を説明せよ
タンパク質はアミノ酸の重合体である。 各アミノ酸は、中心炭素、水素、カルボキシル基、アミノ基、および可変R基を含む。 R基は、帯電した親水性側鎖、極性を持つが帯電していない側鎖、非極性の疎水性側鎖、および特殊なケースなど、どのクラスのアミノ酸に属するかを特定します。
タンパク質は、一次、二次、三次、四次の異なる「層」構造を持っています。 主な機能としては、酵素としての働き、受容体としての働き、輸送分子としての働き、遺伝子発現の制御タンパク質としての働き、などがあります。 酵素は生物学的な触媒であり、永久に変化することなく化学反応を促進させる。 基質や反応物質が結合する「活性部位」を持ち、活性化や阻害(競合阻害剤および/または非競合阻害剤)が可能である。
学習目標
- タンパク質の単量体単位について熟知していることを示す。 アミノ酸
- タンパク質構造の異なる層を定義する
- タンパク質のいくつかの主要な機能を特定する
アミノ酸
タンパク質は生命システムにおいて最も豊富な有機分子の一つで、すべての高分子の中でも最も多様な機能を持っている。 タンパク質は、構造、制御、収縮、または保護であったり、輸送、貯蔵、または膜で機能したり、あるいは毒素または酵素であったりします。 生体システム内の各細胞には、それぞれ固有の機能を持つ数千のタンパク質が含まれている可能性があります。 その構造は、機能同様、実にさまざまです。 しかし、タンパク質はすべてアミノ酸のポリマーであり、直線状に配列している。 アミノ酸は、中心に非対称の炭素があり、そこにアミノ基、カルボキシル基、水素原子、側鎖(R基)が結合している
アミノ酸はタンパク質を構成する単量体である。 各アミノ酸は、α(アルファ)炭素とも呼ばれる中心の炭素原子に、アミノ基(NH2)、カルボキシル基(COOH)、および水素原子が結合した同じ基本構造を持っています。 また、すべてのアミノ酸は、中心原子にR基と呼ばれる別の原子または原子群が結合しています(図1)。
アミノ酸という名前は、基本構造中にアミノ基とカルボン酸基の両方を含むことに由来します。 前述したように、タンパク質に存在するアミノ酸は20種類あります。 このうち10種類は、人体で生成できないため食事から摂取することになり、人間の必須アミノ酸とされています。
それぞれのアミノ酸について、R基(または側鎖)が異なります(図2)。
練習問題

図2. タンパク質によく含まれるアミノ酸は20種類あり、それぞれ化学的性質を決めるR基(変成基)が異なる。
可溶性タンパク質の表面にはどのカテゴリーのアミノ酸があり、内部にはどのアミノ酸があると予想されるか。
側鎖の化学的性質はアミノ酸の性質(すなわち、酸性、塩基性、極性、非極性のいずれか)を決定している。 例えば、アミノ酸のグリシンは、R基として水素原子を持つ。 バリン、メチオニン、アラニンなどのアミノ酸は非極性または疎水性であり、セリン、スレオニン、システインなどのアミノ酸は極性で、親水性の側鎖を持つ。 リジンやアルギニンの側鎖はプラスに帯電しているため、これらのアミノ酸は塩基性アミノ酸とも呼ばれる。 プロリンにはアミノ基と結合したR基があり、リング状の構造を形成しています。 プロリンはアミノ基が側鎖から分離していないので、アニモ酸の標準的な構造とは例外的である(図2)
アミノ酸は1つの大文字か3文字の略語で表わされる。 例えば、バリンはVまたは3文字の記号valで知られています。 脂肪酸が食事に欠かせないように、アミノ酸も必要なものがあります。 必須アミノ酸と呼ばれるもので、ヒトではイソロイシン、ロイシン、システインがこれにあたります。 必須アミノ酸とは、体内では生成されないが、体内のタンパク質を構成するのに必要なアミノ酸を指し、どのアミノ酸が必須かは生物によって異なる。 ペプチド結合の形成は脱水合成反応である。 あるアミノ酸のカルボキシル基が、入ってくるアミノ酸のアミノ基と結合する。 その際、1分子の水が放出される。
アミノ酸の配列と数は、最終的にタンパク質の形、大きさ、機能を決定する。 各アミノ酸は、脱水反応によって形成されるペプチド結合と呼ばれる共有結合によって、別のアミノ酸に結合しています。 あるアミノ酸のカルボキシル基と、結合してくるアミノ酸のアミノ基が結合し、水分子が放出される。 このようにしてできた結合がペプチド結合である(図3)
このような結合でできた生成物をペプチドという。 この伸びる鎖にさらにアミノ酸が結合すると、できた鎖はポリペプチドと呼ばれる。 各ポリペプチドは片方の端に遊離のアミノ基を持っている。 この端はN末端またはアミノ末端と呼ばれ、もう一方の端にはフリーのカルボキシル基があり、C末端またはカルボキシル末端とも呼ばれる。 ポリペプチドとタンパク質は同じ意味で使われることもあるが、ポリペプチドは厳密にはアミノ酸のポリマーであり、タンパク質という言葉は、一緒に結合したポリペプチドまたはポリペプチドが、しばしばペプチド以外の補欠基を持ち、独特の形を持ち、独自の機能を持つものに対して使われる。 タンパク質合成(翻訳)の後、ほとんどのタンパク質は修飾される。 これは翻訳後修飾と呼ばれるものである。 タンパク質は切断されたり、リン酸化されたり、あるいは他の化学基の付加を必要とすることがある。
The Evolutionary Significance of Cytochrome c
Cytochrome cは細胞呼吸の一部である電子輸送チェーンの重要な成分で、通常は細胞小器官のミトコンドリア内に存在する。 このタンパク質はヘムという補欠基を持ち、電子伝達の際にヘムの中心イオンが交互に還元と酸化を繰り返す。 この必須タンパク質は、細胞のエネルギーを作り出すという重要な役割を担っているため、数百万年前からほとんど変化していない。 タンパク質の配列決定により、異なる種の間でかなりの量のチトクロムcアミノ酸配列の相同性があることがわかりました。言い換えれば、さまざまな種のDNAまたはタンパク質配列間の類似性や相違性を測定することにより、進化上の親近感を評価することができます。 このことは、共通の祖先が存在した可能性を示しています。 ヒトとチンパンジーのタンパク質配列を比較したところ、配列の違いは見つかりませんでした。 ヒトとアカゲザルの配列を比較したところ、見つかった違いは1つのアミノ酸の違いだけであった。 別の比較では、ヒトと酵母の配列を比較すると、44番目の位置に違いがあることがわかった。
Protein Structure
先に述べたように、タンパク質の形状はその機能にとって重要である。 たとえば、酵素は活性部位と呼ばれる部位で特定の基質と結合することができます。 この活性部位が局所的な変化やタンパク質全体の構造の変化により変化すると、酵素は基質と結合できなくなる可能性がある。 9267>
一次構造
ポリペプチド鎖のアミノ酸の固有の配列が、その一次構造です。 例えば、膵臓のホルモンであるインスリンにはAとBの2本のポリペプチド鎖があり、それらはジスルフィド結合で結ばれています。 A鎖のN末端アミノ酸はグリシンであり、C末端アミノ酸はアスパラギンである(図4)。 A鎖とB鎖のアミノ酸の配列はインスリンに特有のものである。
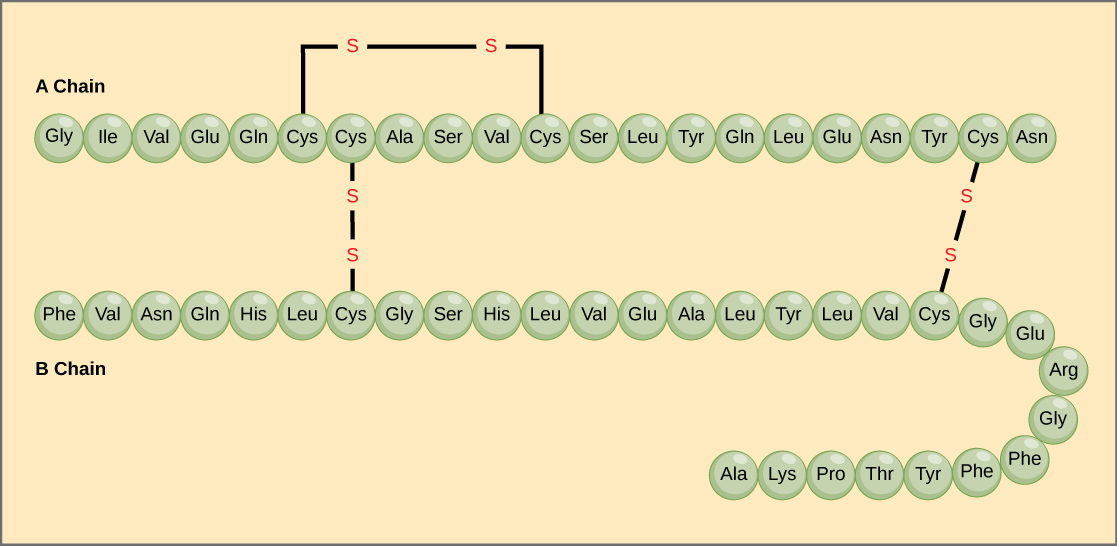
図4. ウシ血清インスリンは、A鎖(アミノ酸長21)とB鎖(アミノ酸長30)の2本のペプチド鎖からなる蛋白質ホルモンである。 それぞれの鎖の一次構造は、アミノ酸の名前を3文字の略号で、存在する順番に表している。 アミノ酸のシステイン(cys)は、側鎖にスルフヒドリル(SH)基を持つ。 2つのスルフヒドリル基は酸素の存在下で反応し、ジスルフィド(S-S)結合を形成することができる。 2つのジスルフィド結合はA鎖とB鎖をつなぎ、3つ目の結合はA鎖が正しい形に折り畳まれるのを助ける。 すべてのジスルフィド結合は同じ長さですが、わかりやすくするために異なるサイズで描かれていることに注意してください。
すべてのタンパク質の固有の配列は、最終的にそのタンパク質をコードする遺伝子によって決定されます。 遺伝子のコード領域のヌクレオチド配列が変わると、成長するポリペプチド鎖に異なるアミノ酸が追加され、タンパク質の構造と機能に変化が生じることがあります。 鎌状赤血球症では、ヘモグロビンβ鎖(図5にその一部を示す)に1つのアミノ酸の置換があり、タンパク質の構造と機能に変化をもたらす。 ヘモグロビンのβ鎖は147残基の長さであるが、1つのアミノ酸の置換によって鎌状赤血球貧血になる。 正常なヘモグロビンでは、7位のアミノ酸はグルタミン酸である。 鎌状赤血球ヘモグロビンでは、このグルタミン酸がバリンに置き換わっている。
具体的には、β鎖の中でグルタミン酸というアミノ酸がバリンに置き換わっている。 ここで注目すべきは、ヘモグロビン分子は2本のα鎖と2本のβ鎖からなり、それぞれが約150個のアミノ酸から構成されていることである。 従って、この分子には約600個のアミノ酸が存在することになる。 正常なヘモグロビン分子と、寿命を大幅に縮める鎌状赤血球分子の構造の違いは、この600個のうちの1個のアミノ酸にあるのです。 さらに驚くべきことは、その600個のアミノ酸はそれぞれ3個のヌクレオチドでコードされており、その変異は1800塩基に1個の塩基変化(点変異)で起こることである
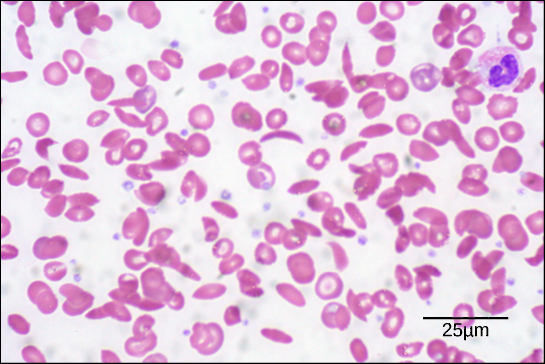
図6. この血液塗抹標本を明視野顕微鏡で535倍に拡大して可視化したところ、鎌状細胞は三日月型、正常細胞は円盤型であることがわかる。 (出典: Ed Uthmanの作品を改変。スケールバーのデータはMatt Russellによる)
鎖のアミノ酸が1つ変化したために、ヘモグロビン分子は長い繊維を形成し、両凹型、つまり円盤型の赤血球を歪めて三日月形または「鎌」型をとり、動脈に詰まりを起こす (図6)。 9267>
二次構造
ポリペプチドの一部の領域での局所的な折り畳みが、タンパク質の二次構造を生じさせる。 最も一般的なものはα-helix構造とβ-pleated sheet構造である(図7)。 どちらもα-ヘリックス構造であり、水素結合によってらせんを形成している。 水素結合は、あるアミノ酸のカルボニル基の酸素原子と、アミノ酸鎖から4つ離れたところにある別のアミノ酸との間に形成される
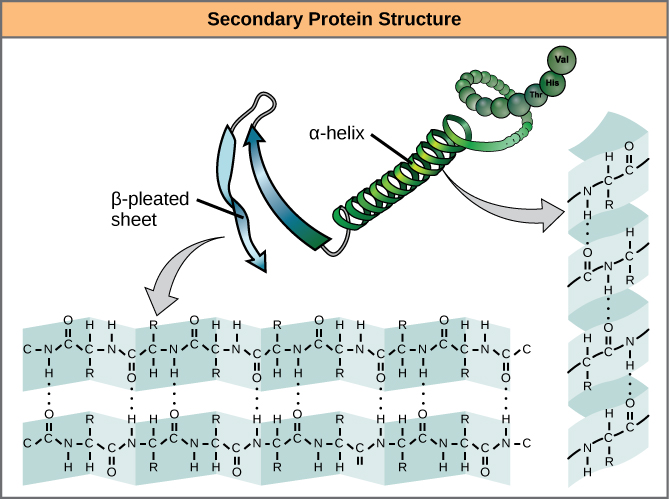
図7. α-ヘリックスとβ-プリーツシートは、ペプチド骨格中のカルボニル基とアミノ基が水素結合することによって形成されるタンパク質の二次構造である。 ある種のアミノ酸はα-helixを形成する傾向があり、他のアミノ酸はβ-pleated sheetを形成する傾向があります。
α-helixのすべてのらせんターンは3.6アミノ酸残基を持っています。 ポリペプチドのR基(バリアント基)は、α-ヘリックス鎖から突き出ています。 β-プリーツシートでは、ポリペプチド鎖の骨格上の原子同士が水素結合することで「プリーツ」が形成されている。 R基は炭素に結合しており、プリーツのひだの上下に伸びている。 プリーツは互いに平行または反平行に並び、ペプチド骨格のアミノ基の部分陽性窒素原子とカルボニル基の部分陰性酸素原子の間で水素結合が形成される。 α-ヘリックスとβ-プリーツシート構造は、ほとんどの球状および繊維状タンパク質に見られ、構造的に重要な役割を果たしている。
三次構造
ポリペプチド特有の三次元構造が三次構造(図8)である。 この構造は、ポリペプチド鎖に働いている化学的相互作用によるところが大きい。 主に、R基同士の相互作用によって、タンパク質の複雑な三次元立体構造が作り出されている。 アミノ酸に含まれるR基の性質は、標準的な二次構造で説明されている水素結合の形成を阻害することがある。 例えば、同じような電荷を持つR基は互いに反発し合い、異なる電荷を持つR基は互いに引き合う(イオン結合)。 タンパク質が折り畳まれるとき、非極性アミノ酸の疎水性R基はタンパク質の内部に、親水性R基は外部に位置する。 前者の相互作用は疎水性相互作用とも呼ばれる。 システイン側鎖間の相互作用は、酸素の存在下でジスルフィド結合を形成し、タンパク質の折り畳み時に形成される唯一の共有結合である
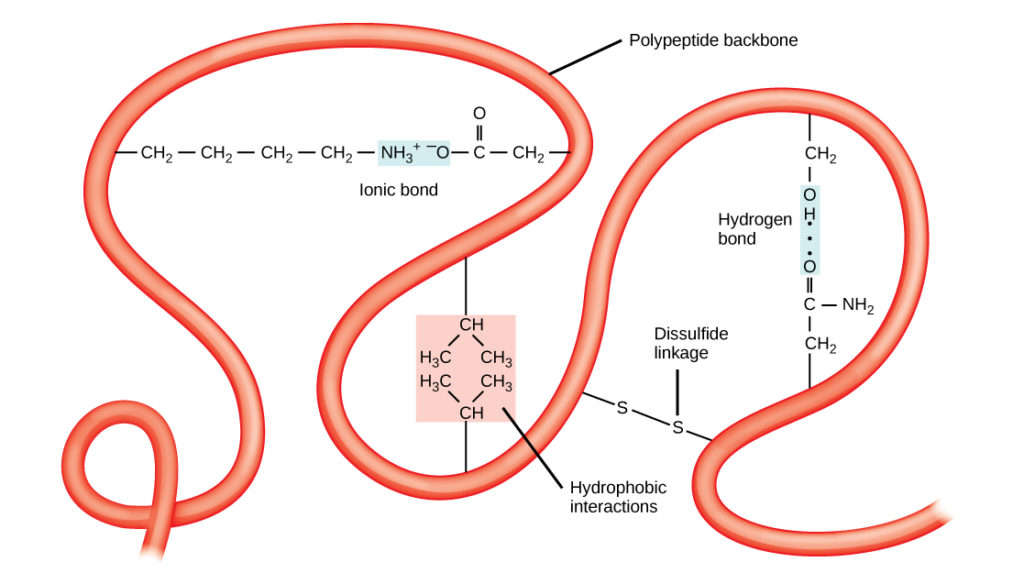
図8. タンパク質の三次構造は、様々な化学的相互作用によって決定される。 これらには疎水性相互作用、イオン結合、水素結合、ジスルフィド結合などがある。
これらの相互作用はすべて、弱いものも強いものもあり、タンパク質の最終的な三次元形状を決定している。
Quaternary Structure
自然界では、いくつかのタンパク質はサブユニットとも呼ばれるいくつかのポリペプチドから形成され、これらのサブユニットの相互作用によって四次構造が形成される。 サブユニット間の弱い相互作用は全体の構造を安定化させるのに役立っている。 例えば、インスリン(球状タンパク質)は、水素結合とジスルフィド結合の組み合わせにより、そのほとんどが球状にまとまっています。 インスリンは最初は単一のポリペプチドで、残りの鎖をつなぎとめるジスルフィド結合が形成された後、翻訳後修飾の存在によって内部の配列がいくつか失われます。 しかし、シルク(繊維状タンパク質)は、異なる鎖間の水素結合の結果であるβ-プリーツシート構造を持っている。
タンパク質構造の4つのレベル(一次、二次、三次、四次)は、図9に示されている(
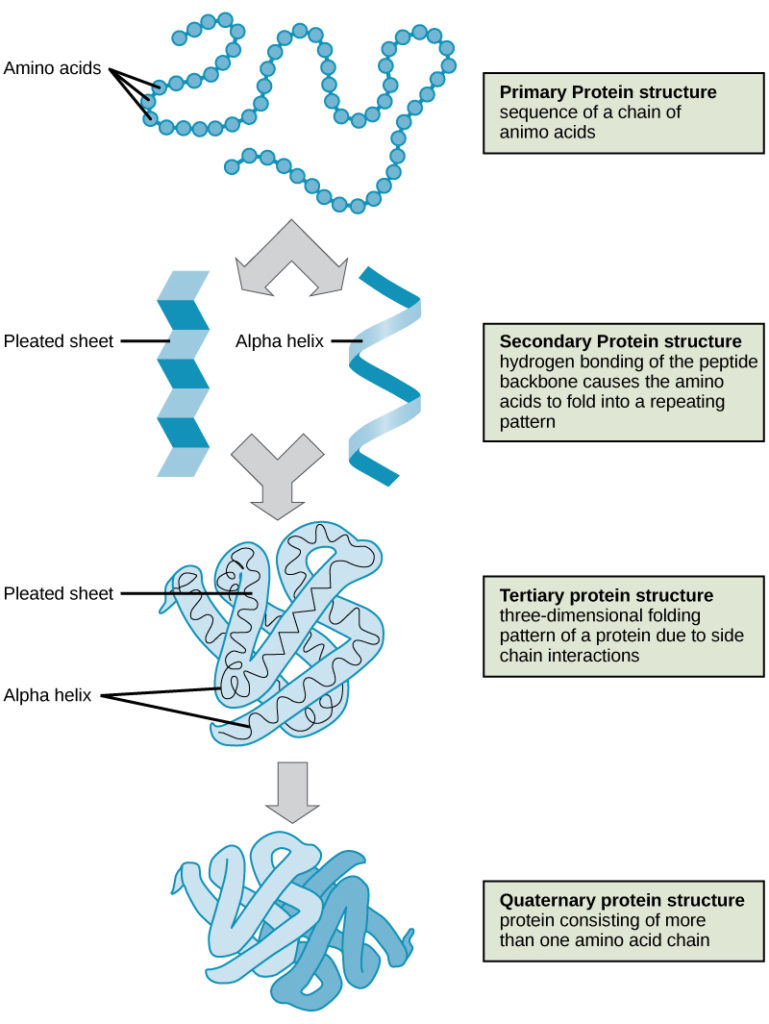
Figure 9. これらのイラストから、タンパク質の4レベルの構造を観察することができる。 (出典: National Human Genome Research Instituteによる著作の改変)
変性とタンパク質フォールディング
それぞれのタンパク質は、独自の配列と形状を持ち、化学的相互作用によって保持されている。 タンパク質が温度やpHの変化を受けたり、化学物質にさらされたりすると、タンパク質の構造が変化し、変性として知られているように、一次配列を失うことなく形状が失われることがあります。 変性は多くの場合可逆的である。なぜなら、変性剤を除去すれば、その過程でポリペプチドの一次構造は保存され、タンパク質はその機能を再開することができるからである。 しかし、変性が不可逆的である場合もあり、その場合はタンパク質の機能が失われる。 例えば、卵を焼くとタンパク質は不可逆的に変性する。 卵白に含まれるアルブミンというタンパク質は、高温のフライパンに入れられると変性してしまう。 すべてのタンパク質が高温で変性するわけではなく、例えば温泉で生きている細菌は、沸騰に近い温度で機能するタンパク質を持っている。 また、胃の中は非常に酸性でpHが低く、消化の過程でタンパク質が変性しますが、胃の消化酵素はこの条件下でも活性を保っています。
タンパク質の機能には、タンパク質の折り畳みが重要です。 当初は、タンパク質自身がフォールディングのプロセスに関与していると考えられていた。 しかし、最近になって、タンパク質が折り畳まれる過程で、シャペロン(またはシャペロニン)と呼ばれるタンパク質ヘルパーから支援を受けることが多いことが分かってきました。 シャペロンは、完全なタンパク質構造を構成するポリペプチドの凝集を防ぐことによって作用し、ターゲットタンパク質が折り畳まれると、タンパク質から分離します」
タンパク質の機能
タンパク質の主な種類と機能を表1に示す。
| 表1. タンパク質の種類と機能 | ||
|---|---|---|
| 種類 | 例 | 機能 |
| 消化酵素 | Amylase, リパーゼ、ペプシン、トリプシン | 栄養素を単量体単位に異化することにより、食物の消化を助ける |
| 輸送 | ヘモグロビンを持つ。 アルブミン | 血液やリンパ液中の物質を体中に運ぶ |
| 構造的 | アクチン、チューブリン、ケラチン | 細胞骨格などさまざまな構造を作る |
| ホルモン | インスリンがある。 チロキシン | 異なる身体システムの活動を調整する |
| 防衛 | 免疫グロブリン | 外国の病原体から身体を守る |
| 収縮 | アクチン, ミオシン | 筋収縮 |
| 貯蔵 | マメ貯蔵タンパク質、卵白(アルブミン) | 胚や苗の初期発生に栄養を与える |
特殊で共通のタンパク質として酵素とホルモンがある。 酵素は生きた細胞で作られるもので、生化学反応(消化など)の触媒であり、通常は複雑な、あるいは共役のタンパク質である。 各酵素は、作用する基質(酵素と結合する反応物)に特異的です。 酵素は、分解、再配列、合成反応のいずれにも関与することができる。 基質を分解する酵素は異化酵素、基質からより複雑な分子を構築する酵素は同化酵素、反応速度に影響を与える酵素は触媒酵素と呼ばれる。 なお、すべての酵素は反応速度を増加させるので、有機触媒とみなされる。
ホルモンは、内分泌細胞から分泌される化学シグナル分子で、通常は小さなタンパク質またはステロイドであり、成長、発達、代謝、生殖など特定の生理過程を制御または調節するために作用します。 例えば、インスリンは血糖値の調節に役立つタンパク質ホルモンです。
タンパク質にはさまざまな形や分子量があり、球状のものもあれば、繊維状のものもあります。 例えば、ヘモグロビンは球状のタンパク質ですが、私たちの皮膚に含まれるコラーゲンは繊維状のタンパク質です。 タンパク質の形状はその機能にとって重要であり、この形状はさまざまな種類の化学結合によって維持されている。 温度やpHの変化、化学物質への曝露などにより、タンパク質の形が永久に変化し、変性と呼ばれる機能喪失に至ることがあります。 すべてのタンパク質は、同じ20種類のアミノ酸の異なる配列で構成されています。
要約:タンパク質
タンパク質は、細胞に対して多様な機能を実行する高分子の一種です。 構造的な支持を提供し、酵素、キャリア、またはホルモンとして作用することによって、代謝を助けます。 タンパク質の構成要素(モノマー)はアミノ酸である。 各アミノ酸は、中央の炭素にアミノ基、カルボキシル基、水素原子、R基または側鎖が結合しています。 一般的に存在するアミノ酸は20種類あり、それぞれR基が異なる。 各アミノ酸は隣のアミノ酸とペプチド結合でつながっている。 アミノ酸の長い鎖はポリペプチドとして知られています。
タンパク質は、一次、二次、三次、(オプションで)四次の4つのレベルで組織化されています。 一次構造は、アミノ酸のユニークな配列である。 ポリペプチドが局所的に折り畳まれてαヘリックスやβプリーツシートのような構造を形成することが二次構造を構成している。 全体の立体構造は三次構造である。 2つ以上のポリペプチドが結合して完全なタンパク質構造を形成している場合は、タンパク質の4次構造と呼ばれる。 タンパク質の形と機能は密接に関係しており、温度やpHの変化により形が変わると、タンパク質が変性して機能が失われる可能性があります。 このクイズは授業の成績には含まれません。また、何度でも再受験できます。
このクイズで理解度を確認し、(1)前のセクションをさらに勉強するか、(2)次のセクションに進むか決定してください。