はじめに
女性における甲状腺機能変化の有病率は非常に高く(甲状腺機能低下症は5/1000、甲状腺機能亢進症は3/1000)1、これらの多くは妊娠可能年齢に発症するので、これらの疾患と妊娠が関連するというのは何もおかしくはありません。 また、妊婦の甲状腺ホルモン(TH)値を測定する臨床が広がるにつれ、他の状況では見過ごされていた甲状腺機能異常が妊婦で検出されることが増えてきた
一方、妊娠中は母親の甲状腺機能が大きく変化し、さまざまな検査項目が変化している。
上記の結果として、近年、妊娠中の甲状腺の生理学と潜在的な変化について関心が持たれている2。 これらのうち、妊娠中(母体および/または胎児)と出産後(母体および/または新生児)の両方における、妊娠中の甲状腺機能亢進症に関する側面、その課題、およびその潜在的影響についてレビューした。
妊娠中の甲状腺機能評価
妊娠中には、母親の甲状腺機能のさまざまなパラメータにかなりの影響を与える著しい生理変化が起こる3、4、以下同様である:
- –
TSH. TSHレベルは、非妊娠時のレベルと比較して、どの妊娠期間においても伝統的に減少が見られ、5 第1期では最低レベルであり、その後、第2期および第3期で上昇する。 TSH値のこれらの変化は、ヒト絨毛性ゴナドトロピン(HCG)値の変化を反映しており、第1期でピークに達し、その後徐々に減少していく。 このため、さまざまな学会が正常な基準値6~8を定めている(表1)。
表1.学会ごとのTSH基準値。
学会 妊娠中のTSH値(μU/ml) 第1期 Second 第3期 第3期 Endo 2007/SEEN 2009 ATA 2011 0.1-2.5 0.2-3 0.3-3 ATA: American Thyroid Association; Endo: Endocrine Society; SEEN: Spanish Society of Endocrinology and Nutrition.
Sources: Stagnaro-Greenら6、Abalovichら7、Galofréら8
TSHレベルの減少は多胎妊娠ではさらに大きく、喫煙する妊婦は第1期と第3期にTSHレベルが低くなることに注意すべき。9
- –
TBGT-T4. 妊娠に伴うエストロゲン値の上昇は、TBG値を上昇させ、その結果、TT4値も上昇させる。 しかし、TT4値の変化は非常に一定しており(150%増加)、その変化は妊娠期間や使用した方法とは無関係である。 したがって、TT4値が利用可能であれば、妊婦のT4産生量は、非妊婦の基準値
- –
FT4 を1.5倍することによって推定することができる。 臨床の現場では、ほとんどのフリーT4(FT4)測定は、ゴールドスタンダードである平衡透析法や限外ろ過法では行われていない。 日常的に使用されている手順は、FT4が直接定量された値ではなく、タンパク質に敏感な方法(TBGやアルブミンの影響を受ける)によって推定される免疫測定システムであり、したがって妊娠によって強く変化し、またトリメスターによって変化するものである。 また、各試験方法には固有のばらつきがある。 つまり、妊娠中のFT4を適切に解釈するためには、米国甲状腺学会(ATA)が述べているように、妊娠期間と使用した方法に応じた基準値を利用できなければならない。6
甲状腺機能亢進症の母体と胎児への影響
表2に示すように、妊娠中の甲状腺機能亢進症は母体と胎児、さらに出生後の新生児に重大な影響を与えることがある10。-12 また、内因性甲状腺機能亢進症では、血栓症のリスクが高まることが最近報告されており、甲状腺機能亢進症のコントロールで明らかに可逆的であることに注意すべきである13。 妊娠中は深部静脈血栓症と肺血栓塞栓症のリスクが高まるため14、この合併症を早期に発見できるよう、高い疑いレベルを維持する必要があり、予防措置を考慮しなければならないかもしれない。
表2.Maternal-fetal impact of hyperthyroidism.
母体
流産
子癇前症(リスク×5倍)7
早産(リスク×10倍)12
母体 胎盤早期剥離
心不全(リスク×20倍)12
甲状腺ストーム(リスク×10倍)12
静脈血栓症13
胎児
低体重児 出生時体重
子宮内発育遅延
未熟児
妊娠期間に対して小さい
胎児死亡
甲状腺機能障害 (甲状腺機能亢進症) または甲状腺機能低下症
胎児甲状腺腫
新生児
一過性の甲状腺機能亢進症
一過性および永久性の甲状腺機能低下症
<出典> (C)2011. Patil-Sisodia and Mestman10 and Laurberg et al.11。
妊娠中の甲状腺機能亢進症の分類
表3は、妊娠中に甲状腺機能亢進症を起こした場合の異なる診断の可能性について述べたものである。 一方では、妊娠そのものに直接起因する多くの病態があり、それらは一過性妊娠性甲状腺中毒症(TGT)という見出しで包含されることがある。 一方、妊娠外で甲状腺機能亢進症になるような症状は、妊娠中にも起こる可能性があります。 最後に、THレベルの上昇は外因性のTH供給によっても起こりうる。
表3.妊娠甲状腺機能亢進症の病因分類。
一過性妊娠性甲状腺中毒症
妊娠悪阻
多胎妊娠
疎性腺機能亢進症(奇胎.脾臓.)
絨毛膜性甲状腺機能低下症 絨毛癌
黄体機能亢進症
家族性妊娠性甲状腺中毒症
多胎妊娠
甲状腺疾患
バセドウ病
甲状腺癌 甲状腺炎
多結節性甲状腺腫
毒性甲状腺腺腫
異所性
過剰治療
不注意な摂取(食物汚染, その他)
Factitious
一過性妊娠性甲状腺中毒症
これは妊娠中の甲状腺機能亢進症の最も多い原因で、全妊娠の1~3%で発生すると言われています15,16。 これは通常、HCGレベルの増加またはTSHレセプターへの親和性の増加の結果である17。
このグループの中で最も特徴的な疾患(表3)は、妊娠悪阻であるが、多胎妊娠や絨毛疾患(水腫や絨毛がん)など、HCG値の上昇と関連する疾患もあり、TGT陽性率は最大で50%である。17 また、妊娠中にテカ・ルテイン嚢胞の形成を特徴とする黄体機能亢進症18 や、胎盤重量とHCG産生量が増加する過胎盤症19 など、あまり一般的ではない原因も存在する。 また、優性常染色体変異により、生理的なHCGレベルに対してTSH受容体が過敏になる家族性疾患(家族性妊娠性甲状腺中毒症20)もある。これは、臨床的には、すべての妊娠でTGTが発症し、家族内のすべての女性がHCGレベルが正常であるという特徴がある。 HGは全妊娠の0.5~10/1000に発生し21、30~60%の症例で遊離TH値の上昇とTSH抑制を伴う。22 HGの概念は、妊娠第1期に嘔吐、脱水、体重の少なくとも5%の減少、ケトン尿を伴う状態に限定すべきであることに注意すべきである23
これらの場合、TSH値の抑制と最低限のFT4増加、一般に正常なFT3値によって、甲状腺機能亢進が特徴づけられる。 甲状腺機能亢進症やそれに伴う嘔吐は、通常20週目までに自然治癒し、ウェルニッケ脳症の例外的なリスクを防ぐには、静脈内水分補給とビタミンB複合体による対症療法で十分である24。 抗甲状腺剤(ATD)による治療が有益であるという証拠はなく25、したがってその使用は好ましくない。6
例外的に、甲状腺機能亢進症の要素が非常に目立つHGや、消化管不耐症(吐き気や嘔吐)を伴うGDは、それらの鑑別診断が必要であることを示唆しているだろう。 表4に主な相違点を示す。 いずれにしても、甲状腺機能亢進症が妊娠第一期を超えて続く場合は、TGT以外の原因を疑うべきである。
表4.バセドウ病と充血の相違点。
バセドウ病 充血 バセドウ病 妊娠前の甲状腺機能亢進症の症状 ++ – 妊娠中の甲状腺機能亢進症の症状 +/++ -/+ 吐き気・嘔吐 -/+ +++ 甲状腺腫・眼精疲労 + – 甲状腺抗体 ++ – T-」とあります。US Hypervascular Normal HGの家族歴 – + 先行妊娠で同様の症状 – + t4 t3 TT3/TT4 比率 >20 T- の場合。US: thyroid ultrasound; HG: Hyperemesis gravidarum(妊娠悪阻)。
バセドウ病
甲状腺疾患の中で、GDは妊娠中の甲状腺機能亢進症の最も多い原因で、全妊娠の0.1-1%に起こる(臨床的甲状腺機能亢進症と潜在的甲状腺機能亢進症をそれぞれ0.4%と0.6%とする)。10
妊娠中のGDの自然経過は、TSH受容体のHCGによる刺激による相加効果で妊娠初期に症状が増悪し、妊娠による免疫調節効果で妊娠後期に改善し、出産後に再発する。
妊娠中のバセドウ病
妊娠中の活動性GDの症状は典型例と異なることはない。 時に妊娠そのものと混同される症状もあります。
妊娠中のバセドウ病の治療
よく知られているように、非妊婦のバセドウ病の治療には、131I、手術、ATDによる内科的治療の3つの方法が考えられる。 この3つの選択肢のうち、131Iの投与は奇形のリスクがあるため妊娠中は禁忌であり7、したがって選択肢は甲状腺切除術かATDの使用に限定される。 手術に関しては、以下に述べるように、例外的な状況においてのみ行われるべきである
。 抗甲状腺剤
妊娠中のGDの内科的治療については、数年前までプロピルチオウラシル(PTU)がメチマゾール/カルビマゾール(MM/CM)と比較して、伝統的に選択すべき治療と考えられていた26。この概念は、MM/CMと比較してPTUの胎盤移行が少ないことを示唆するいくつかの研究27およびMM/CMの催奇形作用に基づくものであった。 現在では、どちらのATDも胎盤を通過するため、胎児に影響を与え、胎児甲状腺機能低下症を引き起こす可能性は同じであることが知られています26。
さらに、胎児の皮膚形成不全、絨毛閉鎖症、食道閉鎖症、その他「メチマゾール胚症」28 と呼ばれる奇形の発生における MM/CM の役割は、非常に議論のあるところです29-31 。 一方、PTUで治療した患者に劇症肝炎を発症した例が近年報告されており34,35、有病率は0.1〜0.5%、死亡率は25〜50%と高く、10,36 PTUで治療した母親から生まれた新生児の新生児肝炎発症例さえ報告されています37,38。
この選択肢に直面したとき、GDの女性の妊娠前にアブレーション治療を推奨した著者もいました39。 一方、この対策では、医学的治療が必要な高レベルの甲状腺刺激抗体(TSI)の持続による最終的な胎児甲状腺機能亢進症(Fhyper)を防げないため、また問題が出てくる。
PTUによる治療開始の遅れを防ぐために,妊娠する可能性があり避妊方法をとっていないGD女性には,自宅にPTUを用意し,妊娠が確認できたらすぐに薬を切り替える(MM/CMからPTU)よう指導することが望ましいとされています。 臨床管理
上述したように,妊娠中のGDの治療は,最初の3ヶ月はPTU,その後はMM/CMを使用することである。 開始用量は、PTUとして50~300mg/日を3回に分けて投与し、メチマゾールとして5~15mg/日、またはカルビマゾールとして10~15mg/日を1回で投与する6。 さらに、プロプラノロールとATDの併用治療で流産が増えると報告した著者もいる42
ATDの投与量を調節するときは、母親の甲状腺機能を潜在的機能亢進の限界付近に維持するよう試みるべきであるが、これは胎児の甲状腺がATDの遮断作用に対してはるかに敏感であるためである。 実際、検出可能なTSHの存在は、ATDの投与量を減らすべきことを示す。10,43
妊娠中のGDは非常に動的な経過を示すため、患者の最大20~30%が妊娠後期にATDを中止できる程度のコントロールに到達している44。 6,43
手術
妊婦のGDをコントロールするための手術の使用に関しては、異なるコンセンサスや臨床ガイドライン6,7,43は、以下の場合にのみ推奨することで一致している:
- 1
ATDsに対する副作用で使用ができない場合。
- 2
ATDの高用量が必要な場合
- 3
患者が治療を遵守しない場合
さらに、イタリアのガイドライン43も気道圧迫のある広範囲の母甲状腺腫例に対して手術を推奨しています
手術を行う場合、第2期以降が最適な時期だと言われています。 このことから、手術の準備として、GDの妊婦にβ遮断薬とヨウ化ナトリウム(50-100mg/日)45を短期間(10-14日)使用することが正当化される。 上述したように、β遮断薬の長期投与は避けるべきである。 甲状腺腫および/またはFhypoの発生を防ぐためにヨウ化カリウムを投与する場合にも注意が必要である。
手術は状況に大きな変化をもたらす。 一方では、妊婦の甲状腺機能亢進症は治るが、母体には甲状腺機能低下症が誘発されるので、迅速な補充と定期的なTSHのモニターが必要である。 TSIレベルも管理し、必要なら胎児の甲状腺機能亢進症もモニターすべきである。
妊娠中の甲状腺自己免疫の変化
一部の著者らは、少なくともいくつかのケースで、TSHレセプターに対する抗体の機能活性が、刺激活性から抑制または遮断活性に変わることを示した46、47これは、妊娠が自己抗体のレベルだけでなく、その機能プロファイルをも調節することを意味している。 この概念は、妊娠中のGDが正常な機能へと進化するだけでなく、いくつかの症例で報告されているように、この刺激-阻止活性の変化により、機能低下へと進化する可能性さえあることを示唆している48。 つまり、妊娠中のGDは変化しやすいプロセスであり、常に定期的なモニタリングを必要とし、ATDを必要としない明らかな寛解の状況に達したとしても、これを無視してはならないのである。
妊娠中の甲状腺刺激抗体の測定
潜在的なTSI自己抗体の胎児の甲状腺への影響を防ぐために、1998年にETAは49、母親のGDの特徴に応じて、妊娠中のTSI測定の適応を確立する基準を発表した(表5)。
表5.欧州甲状腺協会によるTSI測定の適応症。
(I) 妊娠前の内科的治療で治ったGDのEuthyroid女性
– 測定しない
(II) 131I後または外科的に治ったGDのEuthyroid女性
– 早くTSIを測定せよ。 陽性の場合、胎児の甲状腺機能亢進症を監視する
– 妊娠第3期にTSIを測定する(妊娠第1期で陽性の場合)。 陽性の場合、新生児甲状腺機能亢進症をモニターする
(III) 妊娠中にGDの治療を受けた女性
– 第3期のTSIを測定する 陽性の場合、新生児甲状腺機能亢進症をモニターする
GD: バセドウ病のことです。
Source: Laurbergら49
GDが妊娠前に内科治療で治った場合は、免疫状態が治ったと考えられ、TSI測定は必要ない。
アブレーション療法(手術や放射線治療)でGDが治った場合、免疫状態が持続することがあります。 TSI値は通常、手術後12-18ヶ月で陰性化する。 131Iアブレーション治療後は、最初の数ヶ月は値が上昇し、その後低下するが、最長で5年間は高い値を維持することがある。 したがって、妊娠を希望し、TSI値が高い女性では、131Iよりも手術が望ましい。 これらのすべてのケースにおいて、TSI値はHFの潜在的リスクを評価するために早期に測定されるべきであり、妊娠3ヶ月目に再び測定して、陽性が続くかどうか、新生児甲状腺機能亢進症のリスクが存在するかどうかを確認すべきである。
妊娠中に活発なGDがある場合、Fhyperの潜在リスクはATDによる母親の治療によってコントロールされている。
ATA6では約20-24週での検査を勧めており、より一般的な推奨事項を示している:
- –
甲状腺機能亢進症の母親
- –
131Iによる治療歴あり。
- –
甲状腺摘出歴
- –
甲状腺機能亢進症の新生児歴
胎児のバセドウ病
胎児甲状腺は20週から成熟し、そのために成人甲状腺と同じ影響力(ATDsとTSI)に応答できることを覚えておくべきでしょう。 このため、妊娠中のGDではFhypoとFhyperの両方が見られることがある。
胎児甲状腺機能低下症
Fhypoは通常、相対的ATD過剰投与により起こり、母体の機能は正常に保たれても、胎児では明らかに機能低下となる。
示唆的臨床症状
この疾患は、臨床的には、産科超音波検査における胎児甲状腺腫と、ATDで治療した妊婦の多水腫の発症に基づいて疑われることがある。
機能的側面にかかわらず、胎児甲状腺腫の存在は、その質量効果51による警報信号である(図1参照)。 甲状腺の肥大は、胎児の首の後ろの過伸展を引き起こし、その結果、子宮内の胎児の運動性が損なわれ、出生時の異常な体位(肩甲娩出症、逆子など)につながることを考慮する必要がある。 また、この過伸展が胎児の十分な頭位を妨げない場合でも、娩出時に胎児の頸部を十分に屈曲させることができず、顔面提示の原因となります。 これらの状況はすべて、帝王切開の実施を必要とします。 しかし、これは主な合併症ではなく、甲状腺腫が胎児の未熟な気管軟骨を圧迫することにより、気管や食道が圧迫されることがあります。 その結果、気道閉塞が起こり、それに伴って窒息の危険性がある。 さらに、食道の圧迫は羊水の嚥下を妨げ、羊水の貯留と多飲症を引き起こします。 これは新生児の罹患率と死亡率の主な原因である早産を助長します。
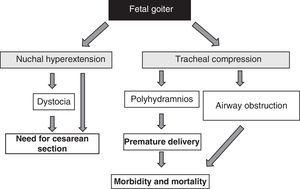 Figure 1.
Figure 1.Consequences of goiter development in the fetus.
(0.1MB).Diagnosis
Fhypo の疑いを確認する唯一の完全に信頼できる手順は、脊索穿刺による胎児 TH レベルの測定である。 これは合併症がないわけではなく(胎児死亡の2%のリスクと関連している52)、単純な羊水穿刺より複雑な手順である。 しかし、羊水中の胎児TH値の測定は信頼性が低く、胎児血液中の測定値との相関はない53。母体由来のTHが羊水中に検出される可能性があることを念頭におく必要がある54。 異なるガイドラインによると、6,43 脊髄穿刺は、母親がATDsを服用している胎児で甲状腺腫が検出され、FhyperまたはFhypoの確実な診断ができない場合にのみ、常に経験のあるセンターで行われるべきである
このアプローチに代えて、胎児のTHsの代謝から生じる複合Wの測定が最近提案されている。 胎児では、成人と異なり、THsの代謝はスルホ共役経路を経て硫酸ジヨードサイロニンを形成する。この化合物は、胎盤と子宮壁でメチル化されてから母体の循環に入り、化合物Wを形成する。この化合物は、胎児の甲状腺機能の発達からすべての妊婦に見られ、妊娠中に次第に増加し、出産後に消失する。 このため、胎児の甲状腺機能のマーカーとして提唱されている55。このような背景から、ATDsで治療した妊婦のコンパウンドW値の進行が不十分であれば、Fhypoの発症を示唆する可能性がある56が、当面は擬似実験的手法に過ぎない<8073>治療<2343>まず取るべき手段は、ATDsを中止することであろう。 しかし、一度中止したATDの効果は潜伏しているため、胎児の甲状腺が完全に回復するまではTHの補充も必要である。 THの胎盤通過は限られているので、羊膜内ルートで投与する必要がある。 57
T4による胎児の羊水内治療に関しては、確立された治療計画はなく、文献データはかなり矛盾している。 これは、最初の投与から0.5-2.5週間後に胎児甲状腺腫を回復させるようである。
胎児甲状腺機能亢進症
Fhyperはまれな合併症で、現在または過去にGDのあった母親から生まれた赤ちゃんの1〜2%までに起こるかもしれないが、おそらく過小診断される状態であろう60,61。
Fhyperの発症は、TSH受容体の突然変異62という非常に稀なケースを除いて、妊婦のGDのコントロール不良の結果であるか、より一般的には、妊娠前にアブレーション療法でGDが治癒した妊婦でTSI値が高い状態が続いている場合に生じる可能性があります。 Fhyperのリスクを確認するためにTSIを測定する適応については、すでに述べたとおりである。 TSI値が正常値の3倍から5倍高い場合6,63は、Fhyperの危険性がある。 64 より重症の場合、胎児水腫を伴う心不全、または精神遅滞を伴う中枢神経系の成熟障害が発生することがある。 65
診断
上記の徴候は決定的なものではなく、頻脈は必ずしも起こらないし、甲状腺腫の存在はFhypoによく見られる所見である。 ATDの影響によるFhypoか、母体のコントロール不良によるFhyperか疑わしい場合、超音波データに基づくスコアリングシステムを提案している著者もいる66(表6)。 疑問が残る場合は、Fhypoの項で述べたように、脊索穿刺で胎児のTHsを測定する必要がある。 コンパウンドW(前に述べた)は将来この目的に役立つかもしれない。
表6.Ultrasound scoring to differentiate hyperthyroidism from hypothyroidism in fetal goiter.
超音波の特徴 胎児心拍数 頻脈 1 正常 0 甲状腺血管 中央部 1 末梢性または欠如 0 胎動 正常であること 1 増加 0 骨粗鬆症 成熟 加速 -1 正常 0 遅延型 1 スコアの解釈 ≥2 が示唆するもの。 甲状腺機能亢進症 Huelらから引用。66治療
治療はATDに基づくべきである。 この場合、Fhypoの場合と異なり、ATDは自由に胎盤を通過するため、羊膜内ルートで治療を行うべきでない。 GDのコントロールが不十分な妊婦にFhyperが発生した場合、母体の治療調整のみが必要である。 一方、母体が事前のアブレーション治療により機能が正常であり、胎児のみが機能亢進を示す場合には、MM/CMを母体に10-20mg/日から投与する。 胎児に過剰投与してFhypoを起こさないように、胎児のHRと甲状腺腫の経過に基づいて、4-5日ごとに治療をモニターする必要があります10
ATDを投与したときに母体が甲状腺機能低下症を起こした場合は、胎盤をほとんど通過せず、胎児に影響を与えずに甲状腺機能低下症を補正するレボチロキシンを投与する必要があります。
新生児のバセドウ病
新生児では、妊娠中のGDは甲状腺機能亢進症と低下症の両方を引き起こすことがある。
新生児甲状腺機能亢進症
これはGD10が活発で最終期のTSI力価が高い妊婦から生まれた赤ちゃんの1-5%で起こることがある。 胎児は、母体が受けたATDの影響により、妊娠中も正常な機能を維持しています。 ATDは24-72時間の半減期を持ち、この期間を過ぎると胎児の甲状腺への作用は停止する。
この状態は、妊娠前にアブレーション治療を受け、TSI値が上昇し続けた母親の新生児にも起こることがあり、その場合、未診断のFhyperが発生したことになります。 これらの場合、新生児甲状腺機能亢進症はFhyperの継続であり、新生児は出生時に重度の病変、低体重、骨の成熟促進を示す。
治療は、臨床経過に応じて、MM/CMを0.5-1mg/kg体重/日、プロプラノロール2mg/kg体重/日36を投与するが、これは一過性であることを念頭において行うことである。 8073>二次性新生児甲状腺機能低下症
GDのコントロールが悪い母親から生まれた赤ちゃんでは、妊娠中にさらされたTHsのレベルが高いためにTSH分泌が抑制され、出生時に二次性甲状腺機能低下症となることが分かっている67。
新生児にはレボチロキシンを投与し、最終的にTSH分泌が回復するまで定期的に評価すべきである。
RSH受容体をブロックする母親の自己抗体の持続による一過性の新生児甲状腺機能低下症も見られることがある68。
産婦のバセドウ病
妊娠前または妊娠後にコントロールされていたバセドウ病が、出産後に再発することがある。 69 したがって、出産後6週間から1年間、母体のTHsを測定することが推奨されています10
GDが再発した場合は、MM/CMによる内科的治療が必要となります。 ATDは母乳中に分泌されるが、授乳中の投与にリスクはなく、MM/CMを20-30mgまで服用しても新生児の甲状腺に影響はない70。ATDは分割服用し、必ず牛乳摂取終了後に服用する。
母乳中のTSIが新生児の未熟な消化管上皮を通して新生児の一般循環に到達して新生児甲状腺機能亢進症を引き起こしたり、延長する可能性も示唆されている。 しかし、それが起こるという決定的な証拠はまだない71
追記
この原稿の投稿後、北米内分泌学会から「妊娠中および産後の甲状腺機能不全の管理」に関する新しい臨床実践ガイドラインが発表された(J Clin Endocrinol Metab 2012; 97: 2543-2565)。 妊娠中の甲状腺機能亢進症の項で示された推奨事項は、本レビューで取り上げたものと実質的に異なるものではない。
利益相反
著者は、利益相反がないとしている。
- –