Oprócz tego, że l-mleczan jest prekursorem glukozy w wątrobie i nerkach, jest on obecnie również rozpoznawany jako substrat energetyczny w większości komórek poprzez jego utlenianie do pirogronianu. To utlenianie, zakładane jako zachodzące w cytozolu, jest katalizowane przez dehydrogenazę l-mleczanową, a pirogronian jest następnie katabolizowany w mitochondriach. Jednakże ostatnio uznano, że mitochondria odgrywają rolę w metabolizmie l-mleczanu: istnienie mitochondrialnej dehydrogenazy l-mleczanowej (m-l-LDH) zostało zasugerowane przez Dianzani (1), a następnie wykazane przez Baba i Sharma (2), że jest ona zlokalizowana w macierzy mitochondrialnej (3). Rzeczywiście, transport i metabolizm l-mleczanu wykazano w różnych mitochondriach, w tym w mięśniach szkieletowych (4), sercu szczura (5), wątrobie (6), mózgu (7-9), komórkach ziarnistych móżdżku (10), mięśniu brzuchatym królika (11), komórkach plemników (12), wątrobie świni (13), a nawet w roślinach (14). W ten sposób istnienie m-l-LDH, zgodnie z przeglądem Passarella i wsp. (3), Brooks (15) i Schurr (16), zostało uznane poprzez włączenie go do MitoCarta (http://www.broadinstitute.org/pubs/MitoCarta/index.htrnl). Zgodnie z oczekiwaniami, w świetle obecności l-LDH w macierzy, w badaniach funkcjonalnych z udziałem oczyszczonych, sprzężonych mitochondriów wykazano występowanie nośników dla l-mleczanu. Należą do nich symporter l-mleczanu/H+ oraz antyporterzy l-mleczanu/pirogronianu i l-mleczanu/oksaloacetatu (3). Co zaskakujące, przytłaczające dowody na istnienie m-l-LDH zlokalizowanego wewnątrz mitochondriów nie są powszechnie akceptowane, niektórzy naukowcy nadal sceptycznie podchodzą do istnienia m-l-LDH, podczas gdy inni lokalizują m-l-LDH w przestrzeni międzybłonowej (17). Naszym zdaniem sceptycyzm ten może wynikać z trudności w izolacji sprzężonych mitochondriów, co nie jest łatwym zadaniem, w szczególności w przypadku próbek mięśni szkieletowych, lub z niedostatecznej ostrożności w doborze mediów reakcyjnych i stosowania inhibitorów w odpowiednim stężeniu (11). To, że m-l-LDH jest zlokalizowany wewnątrz mitochondriów zostanie pokazane poniżej.
Is l-Lactate Being Transported and Metabolized in Cancer Cell Mitochondria?
Yes, it is. Chociaż w latach 20-tych Warburg stwierdził, że komórki nowotworowe wolą produkować ATP przez glikolizę z produkcją l-mleczanu, według naszej najlepszej wiedzy, mitochondrialny metabolizm l-mleczanu nie był badany w komórkach nowotworowych aż do 2010 roku, kiedy to opublikowano pierwsze dowody na mitochondrialny metabolizm l-mleczanu w tych komórkach (zgłoszony już w 2008 roku przez Gabriellę Chieppę w jej pracy doktorskiej na Uniwersytecie w Molise) (18). W tym przypadku, w celu zbadania transportu i metabolizmu l-mleczanu w mitochondriach wyizolowanych zarówno z prawidłowych, jak i nowotworowych komórek prostaty, zastosowano techniki spektroskopowe i polarograficzne, w których monitorowano odpowiednio reakcję m-l-LDH lub zużycie tlenu przez mitochondria, zasilane zewnętrznie dodanym l-mleczanem (19), zamiast stosowania bardziej skomplikowanych procedur, dostępnych w laboratoriach biologii molekularnej, genetyki i chemii. Wybrano dwie pierwsze techniki, ponieważ umożliwiają one ciągłe monitorowanie kinetyki badanych procesów w trwających kilka minut eksperymentach, w których mitochondria pozostają sprzężone. Natomiast pomiary ostatnimi metodami wykonywane są zazwyczaj po zakończeniu procesów. Zgodnie z powyższym, wzrost stanu redoks wewnątrzmitochondrialnych nukleotydów pirydynowych, wykazany pomiarami fluorymetrycznymi, po dodaniu l-mleczanu do mitochondriów wskazuje, że metabolizm l-mleczanu zachodzi wewnątrz organelli za pośrednictwem zależnej od NAD+ m-l-LDH; niestety, występowanie mitochondrialnego metabolizmu l-mleczanu w komórkach nowotworowych nie zostało przytoczone w pracy Fergusona i wsp. (17) być może dlatego, że autorzy przeglądu uważają techniki spektroskopowe i polarograficzne za „problematyczne”, pomimo ich szerokiego zastosowania przez wielu naukowców. O tym, że jest to opinia mniejszości może świadczyć cytat z recenzji Mayevsky’ego i Rogatsky’ego (20), którzy stwierdzają, że „Duża liczba publikacji różnych grup świadczy o cennych informacjach zebranych w różnych warunkach eksperymentalnych. Monitorowanie poziomu NADH w tkankach dostarcza najważniejszych informacji na temat stanu metabolicznego mitochondriów.” Istnienie m-l-LDH może być również potwierdzone immunologicznie w mitochondriach, które okazały się być wolne od zanieczyszczeń cytozolowych.
Uwaga, że w przypadku, gdy proponuje się lokalizację m-l-LDH w przestrzeni międzybłonowej, wzrost wewnątrzmitochondrialnej fluorescencji nukleotydu pirydynowego wyjaśnia się w następujący sposób: l-mleczan dostaje się do przestrzeni międzybłonowej mitochondrium, gdzie jest utleniany do pirogronianu, który z kolei przekracza wewnętrzną błonę mitochondrialną, aby zostać utleniony wewnątrz mitochondrium przez kompleks dehydrogenazy pirogronianowej. Taki mechanizm nie jest wspierany przez różne wyniki badań eksperymentalnych. Na przykład, w pracy de Bari i wsp. (18) wykazano, że redukcja NAD+ przebiega pomimo obecności arsenitu, inhibitora dehydrogenazy pirogronianowej, ale jest hamowana przez oksaminian, inhibitor l-LDH. Dodatkowe dowody przeciwko obecności m-l-LDH w przestrzeni międzybłonowej pochodzą z wyników eksperymentalnych pokazujących, że l-mleczan dostaje się do mitochondriów w warunkach, gdy pirogronian jest związkiem niepenetrującym (21) lub gdy symporter pirogronianu/H+ jest blokowany przez inhibitor (6). Te eksperymentalne podejścia mogą być również zastosowane do pomiarów zużycia tlenu (w obecności lub nieobecności ADP), odpływu protonów i wytwarzania potencjału błonowego w przyszłości. Przez zastosowanie kryterium siły kontroli z różnymi niepenetrującymi inhibitorami (19) można ustalić, czy szybkość powyższych procesów odzwierciedla szybkość transportu l-mleczanu przez błonę mitochondrialną, czy też nie. W ten sposób transport l-mleczanu może być zbadany ilościowo, włączając w to występowanie kinetyki hiperbolicznej, profil pH, itp. Ponadto, porównanie profili hamowania procesów mitochondrialnych zależnych od pirogronianu i l-mleczanu poprzez zastosowanie związków, które nie są w stanie wnikać do mitochondriów, pozwala na rozróżnienie pomiędzy nośnikami l-mleczanu i pirogronianu.
W skrócie, wykazano również, że zewnętrznie dodany l-mleczan może wnikać zarówno do normalnych, jak i nowotworowych komórek prostaty, a w szczególności, w sposób pośredniczący w przenoszeniu, wnika do ich mitochondriów, gdzie istnieje l-LDH zlokalizowana w przedziale wewnętrznym. Wykazano, że m-l-LDH różnią się od enzymów cytozolowych, które z kolei różnią się między sobą. Komórki prawidłowe i nowotworowe wykazują różnice w odniesieniu do poziomu i aktywności białka m-l-LDH, przy czym zarówno ekspresja enzymu, jak i jego aktywność są wyższe w komórkach nowotworowych.
W 2011 roku wykazano istnienie transportera monokarboksylanowego (MCT) i białka LDH w siateczce mitochondrialnej linii komórkowych raka piersi (22). W tym przypadku zmierzono ekspresję zarówno MCT, jak i l-LDH, a ich lokalizację mitochondrialną określono za pomocą immunofluorescencji, techniki, która nie pozwala na identyfikację lokalizacji submitochondrialnej.
Szerzej badanie transportu i metabolizmu l-mleczanu w mitochondriach komórek nowotworowych przeprowadzono w komórkach ludzkiego raka wątrobowokomórkowego (Hep G2) (21), w których zachodzi glukoneogeneza (23). Mitochondria komórek Hep G2 (Hep G2-M) posiadają m-l-LDH ograniczony do wewnętrznego przedziału mitochondrialnego. Stwierdzono również, że cytozolowa i mitochondrialna l-LDH różnią się od siebie kinetyką nasycania. Wykazano również występowanie w tych mitochondriach transportu l-mleczanu z udziałem nośnika. Co ważne, po raz pierwszy wykazano odpływ różnych metabolitów, w tym pirogronianu, oksalooctanu, jabłczanu i cytrynianu, w wyniku dodania l-mleczanu do mitochondriów, co dało pierwszy wgląd w rolę mitochondrialnego metabolizmu l-mleczanu; odpowiednio, wykazano również występowanie wahadła l-mleczan/pirogronian przeznaczonego do utleniania cytozolowego NADH. Ostatecznie, usunięcie produktu utleniania przez transport z udziałem nośnika i metabolizm mitochondrialny przezwycięża wszelkie teoretyczne trudności termodynamiczne, które uważano za wykluczające utlenianie l-mleczanu w mitochondriach.
Te odkrycia silnie sugerują, że konieczna jest rewizja dogmatycznego poglądu na metabolizm glukozy, ze szczególnym uwzględnieniem roli l-mleczanu i m-l-LDH w glukoneogenezie. Rewizji wymaga również cykl Coriego (sformułowany w 1929 roku jako energetyczny szlak metaboliczny u zwierząt, w którym atomy węgla glukozy przemieszczają się okrężną drogą: glikogen mięśniowy → mleczan we krwi → wątroba (gdzie zachodzi glukoneogeneza) → glukoza we krwi → glukoza mięśniowa → glikogen mięśniowy). W tym kontekście, komórkowe utlenianie l-mleczanu, które jest niezbędne do produkcji glukozy w cyklu Coriego, tradycyjnie postulowano jako zachodzące w cytozolu, ale czy tak jest? Cytozolowe-l-LDH (c-l-LDH) jest enzymem redukującym, ostatnim etapem szlaku glikolitycznego, który przekształca pirogronian do l-mleczanu, a tym samym zapewnia regenerację NAD+. Reakcja ta powinna przebiegać bez zakłóceń, niezależnie od obecności lub braku tlenu, ponieważ standardowa zmiana energii swobodnej (ΔG0′) konwersji pirogronianu do l-mleczanu wynosi około -6 kcal/mol. Ponadto, wysokie powinowactwo pirogronianu do c-l-LDH tłumaczyłoby fakt, że normalny / stosunek we krwi i innych tkankach jest >10, wartość, która nie może odpowiadać propozycji pirogronianu jako produktu końcowego glikolizy w normalnych warunkach. Dlatego dogmatyczne przedstawienie tej reakcji jako dwukierunkowej jest mylące i zostało przyjęte do tej pory ze względu na brak możliwej alternatywy. Twierdzimy, że utlenianie l-mleczanu z powrotem do pirogronianu nie odbywa się w cytozolu, ale raczej ma miejsce w mitochondriach. Rzeczywiście, istnieją tylko dwie możliwości zapobiegania akumulacji l-mleczanu w cytozolu, albo l-mleczan jest transportowany z komórki (w warunkach beztlenowych) i/lub jest utleniany przez m-l-LDH podczas jego transportu do mitochondrium (w warunkach tlenowych). Dlatego, nawet jeśli zgodzimy się z Lu et al. (24), że „większość pirogronianu pochodzącego z glikolizy jest kierowana do fermentacji mleczanowej”, nie możemy przyjąć, że l-mleczan jest „trzymany z dala od mitochondrialnego metabolizmu oksydacyjnego.”
Szczególnie interesujący jest fakt, że pirogronian nie może wejść do Hep G2-M. W rzeczywistości, w przeciwieństwie do jabłczanu + glutaminianu i l-mleczanu, zewnętrznie dodany pirogronian nie powoduje ani zużycia tlenu, ani generacji potencjału błonowego. Zauważmy, że upośledzenie transportu pirogronianu w komórkach nowotworowych zostało zgłoszone przez Paradies et al. (25). Dlatego, niezależnie od teoretycznej niewykonalności utleniania l-mleczanu w cytozolu, jak wyjaśniono powyżej, klasyczny cykl Cori nie może zachodzić w komórkach Hep G2. Dlatego proponujemy zmieniony cykl Cori (Rysunek 1), który obejmuje zarówno mitochondrialne nośniki, które pośredniczą w ruchu zależnym od l-mleczanu, jak i m-l-LDH, który dostarcza pirogronianu wewnątrz mitochondriów. W związku z tym, pojawienie się poza mitochondriami oksalooctanu i jabłczanu pochodzącego z wychwytu i metabolizmu l-mleczanu poprzez m-l-LDH, dehydrogenazę pirogronianową, karboksylazę pirogronianową i dehydrogenazę jabłczanową oraz poprzez wymianę, prawdopodobnie dzięki antyporterom l-mleczan/oksalooctan i l-mleczan/malan, potwierdza anaplerotyczną rolę l-mleczanu w glukoneogenezie, w której mitochondria odgrywają wyjątkową rolę. Co ważne, dodanie l-mleczanu do Hep G2-M powoduje pojawienie się poza mitochondriami cytrynianu, prekursora kwasów tłuszczowych. Odpowiednio, dzięki zastosowaniu spektrometrii mas o wysokiej rozdzielczości, stwierdzono wychwyt l-mleczanu do mitochondriów komórek HeLa i H460 i udowodniono, że prowadzi on do syntezy lipidów; dodatkowo transmisyjna mikroskopia elektronowa potwierdziła, że LDH jest zlokalizowany w mitochondriach (26). Co zaskakujące, anaplerotyczna rola mitochondrialnego metabolizmu l-mleczanu nie była brana pod uwagę przy „ponownym badaniu” metabolizmu nowotworów (27).
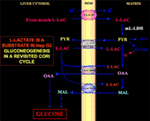
Figure 1. Ponowne badanie cyklu Cori w komórkach Hep G2. Biorąc pod uwagę, że pirogronian nie może wejść do Hep G2-M, jak pokazano w Pizzuto i wsp. (21), l-mleczan produkowany w mięśniach dociera do wątroby poprzez strumień krwi i z cytozolu dostaje się do mitochondriów; w macierzy metabolizm l-mleczanu prowadzi do powstania pirogronianu (PYR) przez m-L-LDH, a następnie do oksalooctanu (OAA) i jabłczanu (MAL), które są eksportowane z mitochondriów do cytozolu przez trzy przypuszczalne nośniki, wykorzystywane do transportu l-mleczanu i pirogronianu oraz do glukoneogenezy w mechanizmie podobnym do tego, który został już wykazany przez de Bari i wsp. (6).
Wierzymy, że proponowana rewizja cyklu Cori, niezbędna dla komórek Hep G2, powinna być również rozważana we wszystkich innych typach komórek, w których aktywny jest mitochondrialny metabolizm l-mleczanu. Na przykład, częściowa rekonstrukcja glukoneogenezy in vitro wynikająca z mitochondrialnego wychwytu/metabolizmu l-mleczanu została wykazana przy braku LDH poza mitochondriami (6).
Rola mitochondrialnego metabolizmu l-mleczanu zasługuje na dalszą uwagę: biorąc pod uwagę, że produkcja nadtlenku wodoru w mikrośrodowisku guza napędza anaboliczny wzrost komórek nowotworowych (28), należy zbadać możliwą rolę putative mitochondrialnej oksydazy l-mleczanowej (LOX), która generuje nadtlenek wodoru w mitochondriach wątroby szczura (29); istnienie LOX w Hep G2-M wydaje się być zgodne z dowodami, że rotenon, który blokuje zużycie tlenu indukowane przez dodanie jabłczanu + glutaminianu nie hamuje zużycia tlenu indukowanego przez dodanie l-mleczanu.
Author Contributions
SP wymyślił tę opinię, podzielił się nią i napisał pracę z AS.
Conflict of Interest Statement
Autorzy deklarują, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych relacji, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Recenzent zadeklarował wspólne powiązanie, bez współpracy, z jednym z autorów do redaktora prowadzącego.
1. Dianzani MU. Dystrybucja oksydazy kwasu mlekowego w wątrobie i komórkach nerek normalnych szczurów i szczurów z tłuszczowym zwyrodnieniem wątroby. Arch Fisiol (1951) 50:181-6.
Google Scholar
2. Baba N, Sharma HM. Histochemistry of lactic dehydrogenase in heart and pectoralis muscles of rat J Cell Biol (1971) 51:621-35.
Google Scholar
3. Passarella S, de Bari L, Valenti D, Pizzuto R, Paventi G, Atlante A. Mitochondria i metabolizm L-mleczanu. FEBS Lett (2008) 582:3569-76. doi:10.1016/j.febslet.2008.09.042
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Dubouchaud H, Butterfield GE, Wolfel EE, Bergman BC, Brooks GA. Endurance training, expression, and physiology of LDH, MCT1, and MCT4 in human skeletal muscle. Am J Physiol Endocrinol Metab (2000) 278:E571-9. doi:10.1152/ajpendo.2000.278.4.E571
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Valenti D, de Bari L, Atlante A, Passarella S. L-lactate transport into rat heart mitochondria and reconstruction of the L-lactate/pyruvate shuttle. Biochem J (2002) 15:101-4. doi:10.1042/bj3640101
PubMed Abstract | CrossRef Full Text | Google Scholar
6. de Bari L, Atlante A, Valenti D, Passarella S. Partial reconstruction of in vitro gluconeogenesis arising from mitochondrial L-lactate uptake/metabolism and oxaloacetate export via novel L-lactate translocators. Biochem J (2004) 380:231-42. doi:10.1042/bj20031981
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Schurr A. Lactate: the ultimate cerebral oxidative energy substrate? J Cereb Blood Flow Metab (2006) 26:142-52. doi:10.1038/sj.jcbfm.9600174
CrossRef Full Text | Google Scholar
8. Schurr A, Payne RS. Lactate, not pyruvate, is neuronal aerobic glycolysis end product: an in vitro electrophysiological study. Neuroscience (2007) 147:613-9. doi:10.1016/j.neuroscience.2007.05.002
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Hashimoto T, Hussien R, Cho H-S, Kaufer D, Brooks GA. Evidence for a mitochondrial lactate oxidation complex in rat neurons: a crucial component for a brain lactate shuttle. PLoS One (2008) 3:e2915. doi:10.1371/journal.pone.0002915
CrossRef Full Text | Google Scholar
10. Atlante A, de Bari L, Bobba A, Marra E, Passarella S. Transport i metabolizm L-mleczanu występują w mitochondriach komórek ziarnistych móżdżku i są modyfikowane w komórkach poddawanych apoptozie zależnej od niskiego poziomu potasu. Biochim Biophys Acta (2007) 1767:1285-99. doi:10.1016/i.bbabio.2007.08.003
CrossRef Full Text | Google Scholar
11. Passarella S, Paventi G, Pizzuto R. Mitochondrialna afera dehydrogenazy L-mleczanowej. Front Neurosci (2014) 8:407. doi:10.3389/fnins.2014.00407
CrossRef Full Text | Google Scholar
12. Paventi G, Lessard C, Bailey JL, Passarella S. W kapacytacji plemników knura L-mleczan i bursztynian, ale nie pirogronian i cytrynian, przyczyniają się do wzrostu potencjału błony mitochondrialnej monitorowanego za pomocą fluorescencji safraniny O. Biochem Biophys Res Commun (2015) 462:257-62. doi:10.1016/j.bbrc.2015.04.128
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Paventi G, Pizzuto R, Passarella S. The occurrence of L-lactate dehydrogenase in the inner mitochondrial compartment of pig liver. Biochem Biophys Res Commun (2017) 489:255-61. doi:10.1016/j.bbrc.2017.05.154
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Paventi G, Pizzuto R, Chieppa G, Passarella S. L-lactate metabolism in potato tuber mitochondria. FEBS J (2007) 274:1459-69. doi:10.1111/j.1742-4658.2007.05687.x
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Brooks GA. Komórkowo-komórkowe i wewnątrzkomórkowe czółenka mleczanowe. J Physiol (2009) 587:5591-600. doi:10.1113/jphysiol.2009.178350
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Schurr A. Mózgowa glikoliza: wiek uporczywego nieporozumienia i błędnego rozumowania. Front Neurosci (2014) 8:360. doi:10.3389/fnins.2014.00360
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Ferguson BS, Rogatzki MJ, Goodwin ML, Kane DA, Rightmire Z, Gladden LB. Metabolizm mleczanu: kontekst historyczny, wcześniejsze błędne interpretacje i obecne zrozumienie. Eur J Appl Physiol (2018) 118:691-728. doi:10.1007/s00421-017-3795-6
PubMed Abstract | CrossRef Full Text | Google Scholar
18. de Bari L, Chieppa G, Marra E, Passarella S. L-lactate metabolism can occur in normal and cancer prostate cells via the novel mitochondrial L-lactate dehydrogenase. Int J Oncol (2010) 37:1607-20. doi:10.3892/ijo-00000815
CrossRef Full Text | Google Scholar
19. Passarella S, Atlante A, Valenti D, de Bari L. The role of mitochondrial transport in energy metabolism. Mitochondrion (2003) 2:319-43. doi:10.1016/S1567-7249(03)00008-4
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Mayevsky A, Rogatsky GG. Funkcja mitochondrialna in vivo oceniana za pomocą fluorescencji NADH: od modeli zwierzęcych do badań na ludziach. Am J Physiol Cell Physiol (2007) 292:C615-40. doi:10.1152/ajpcell.00249.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Pizzuto R, Paventi G, Porcile C, Sarnataro D, Daniele A, Passarella S. Metabolizm L-mleczanu w mitochondriach komórek HEP G2 dzięki dehydrogenazie L-mleczanowej determinuje występowanie wahadła mleczan/pirogronian oraz pojawienie się oksalooctanu, jabłczanu i cytrynianu poza mitochondriami. Biochim Biophys Acta (2012) 1817:1679-90. doi:10.1016/j.bbabio.2012.05.010
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Hussien R, Brooks GA. Mitochondrialny i plazmatyczny transporter mleczanu i ekspresja izoform dehydrogenazy mleczanowej w liniach komórkowych raka piersi. Physiol Genomics (2011) 43:255-64. doi:10.1152/physiolgenomics.00177.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Okamoto T, Kanemoto N, Ban T, Sudo T, Nagano K, Niki I. Establishment and characterization of a novel method for evaluating gluconeogenesis using hepatic cell lines, H4IIE and HepG2. Arch Biochem Biophys (2009) 491:46-52. doi:10.1016/j.abb.2009.09.015
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Lu J, Tan M, Cai Q. Efekt Warburga w progresji nowotworu: mitochondrialny metabolizm oksydacyjny jako mechanizm antymetastazowy. Cancer Lett (2015) 356:156-64. doi:10.1016/j.canlet.2014.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Paradies G, Capuano F, Palombini G, Galeotti T, Papa S. Transport pirogronianu w mitochondriach z różnych komórek nowotworowych. Cancer Res (1983) 43:5068-71.
PubMed Abstract | Google Scholar
26. Chen YJ, Mahieu NG, Huang X, Singh M, Crawford PA, Johnson SL, et al. Metabolizm mleczanowy jest związany z mitochondriami ssaków. Nat Chem Biol (2016) 12:937-43. doi:10.1038/nchembio.2172
PubMed Abstract | CrossRef Full Text | Google Scholar
27. San-Millán I, Brooks GA. Ponowne badanie metabolizmu nowotworów: produkcja mleczanu dla kancerogenezy może być celem i wyjaśnieniem efektu Warburga. Carcinogenesis (2017) 38:119-33. doi:10.1093/carcin/bgw127
CrossRef Full Text | Google Scholar
28. Martinez-Outschoorn UE, Lin Z, Trimmer C, Flomenberg N, Wang C, Pavlides S, et al. Cancer cells metabolically „fertilize” the tumor microenvironment with hydrogen peroxide, driving the Warburg effect: implications for PET imaging of human tumors. Cell Cycle (2011) 10:2504-20. doi:10.4161/cc.10.15.16585
CrossRef Full Text | Google Scholar
29. de Bari L, Valenti D, Atlante A, Passarella S. L-mleczan generuje nadtlenek wodoru w oczyszczonych mitochondriach wątroby szczura dzięki putatywnej oksydazie L-mleczanowej zlokalizowanej w przestrzeni międzybłonowej. FEBS Lett (2010) 584:2285-90. doi:10.1016/j.febslet.2010.03.038
CrossRef Full Text | Google Scholar
.